ALZHEIMER HASTALIĞI
(kapsamlı web versiyonu)
Yazanlar: İ. Hakan Gürvit, Zerrin Yıldırım
Son güncelleme tarihi: 13.12.2020
Kazanılmış entellektüel becerilerin yitirilmesi olarak demans antik çağlardan beri bilinen bir durumdur. Yaşlılık gerek Antik Yunanda, gerekse de Romada bir yandan bilgelikle, diğer yandan da kaçınılmaz kognitif bozulmayla eşlenmiştir. Yunan tanrısı Geras ve onun Romalı eşdeğeri Senectus bilgelik, şöhret ve cesaret temsilcileridir. Geras yaşlılık tıbbı geriyatri ve yaşlılık bilimi gerontolojiye de adını verirken Senectusun adı yaşlılık kelimesinin tıbbi karşılığı olarak kullanılan senilite teriminde yaşamaktadır. Zihinsel bozulmanın yaşlanmanın kaçınılmaz sonucu olduğu düşüncesi Antik felsefenin en önemli isimleri olan Plato ve Aristoteles tarafından da ileri sürülmüştür. Cicero aktif bir zihinsel yaşamın kognitif bozulmayı geciktirebileceğini söyleyen ilk isimlerdendir. Zihinsel bozulmanın yaşlılığın kaçınılmaz bir sonucu olmanın yanısıra bir hastalık olabileceği fikri tıp mesleğinin babaları olan Antik Yunanda Hippokrates, Romada Galenius tarafından ileri sürülmüştür. Demansın bir hastalık olduğu fikri tartışmasız olarak ilk kez İbn-i Sina tarafından ifade edilecektir. İbn-i Sinanın (Latince ismiyle Avicenna) 1025 yılında tamamladığı büyük eseri beş ciltlik El Kanun fit-Tıb veya Latince ismiyle Canon Medicinaenin üçüncü cildinde beyin hastalıklarından söz edilir. Zihinsel bozukluklar Nisyan başlığında toplanır ve üç alt grupta sınıflanır: 1. Fesad-ül Zikir, 2. Fesad-ül Fikir, 3. Fesad-ül Tahayyül. Ayrıntısına girildiğinde bu üç alt sınıfın ilkinde bellek bozukluğu ile Alzheimer hastalığını (AH), ikincisinde kişilik değişikliği ile fronto-temporal demansı (FTD) ve üçüncüsünde halüsinasyonlar ve uyku bozuklukları ile Lewy cisimcikli demansı (LCD) tanımladığı anlaşılmaktadır. Skolastik Çağın sonlanması ve Modernite ile birlikte ampirik bilimlerin öne çıkmasıyla, tıp alanında da deneysel yöntem yeniden itibar kazanacak ve yaşamları içinde zihinsel bozukluk sergileyen hastaların otopsilerinde 17. yüzyıldan itibaren beyin atrofisi bulgusu kaydedilecektir.
Ancak, AHnin ilk olgusu olma onuru bayan Auguste D.ye aittir ve bu tek olgunun Dr. Alois Alzheimer tarafından bildirilmesi tıp tarihinde demans hastalıklarının modern miladı sayılır. Alois Alzheimer 14 Haziran 1864te Kuzeybatı Bavyerada Würzburg yakınlarında küçük bir köy olan Marktbreitta doğmuştu. Liseyi Würzburg yakınlarındaki Aschaffenburgda bitirdikten sonra 1884te Tıp okumaya başladı ve sırasıyla Berlin, Tübingen ve Würzburg Tıp Fakültelerinde okudu. 1887de Über die Ohrenschmalzdrüsen (Dış Kulak Yolu Ter Bezleri Üzerine) isimli doktora tezini yazarak doktor oldu. Aralık 1888de Frankfurt am Mainda Akıl Hastanesinde asistan doktor olarak tıbbi kariyerine başladı. Bir yıl sonra nöropatoloji ilgisini borçlu olduğu, sonradan yakın dostu olacak, kendisinden dört yaş büyük olan Franz Nissl da aynı hastaneye gelecektir. Nissl aynı isimli boyama tekniğini geliştirerek (başlıca krezil viyole ile nöronal çekirdek ve endoplazmik retikulumun ayırt edilmesi) nöropatolojide kayda değer bir çığır açmıştı. Alzheimer, yine dönemin önde gelen nöropatologlarından olan Max Bielschowskynin kendi adıyla anılan ve sinir liflerinin görüntülenmesinde Ramon y Cajalın tekniğini geliştiren gümüş boyama yöntemini de öğrenecektir. Frankfurtta 1895te başasistan oldu. Alzheimer Mart 1903de Emil Kraepelinin daveti üzerine önce Heidelberge gitti ve aynı yılın Ekim ayında yine Kraepelin ile birlikte Münihe geçti. Münihte beyin anatomisi laboratuarının lideri haline geldi. Bu laboratuar uluslararası araştırmacılar için bir çekim merkezi haline gelecektir. Alzheimere asistanlık yapan sonradan ünlü olacak çok sayıda isim arasında Creutzfeldt-Jakob hastalığına adını veren Hans Gerhardt Creutzfeldt ve Lewy cisimciklerine adını veren Friedrich Heinrich Lewy sayılabilir. Alzheimer 1904 yılında Differential Diagnose der Progressiven Paralyse isimli habilitasyon tezini vererek profesör oldu. 1912 yılında Friedrich-Wilhelm Üniversitesinde psikiyatri kürsüsü başkanlığı için Breslauya geçti (günümüzde Polonyadaki Wroclaw kenti). Yolculuk sırasında yakalandığı enfeksiyöz hastalıktan ömrünün sonuna kadar tam olarak iyileşemedi ve 19 Aralık 1915te Breslauda öldü. Münihte boşalttığı pozisyona Spielmeyer-Vogt hastalığına adını veren Walther Spielmeyer, Breslaudakine ise henüz daha 30 yaşında olan FH Lewy geçecektir.
Bugün artık soyadının Deter olduğunu bildiğimiz Alzheimerin bildirdiği olgu Auguste D. 1850 Mayısında Hesse eyaletinin Kassel kentinde doğmuştu. 1890ların sonlarına doğru bellek ve dil bozuklukları şeklinde tanımlanan demans semptomları geliştirmeye başladı. Kısa zamanda ciddi psikotik özellikler ve ajitasyon eklendi ve Kasım 1901de, Alois Alzheimer tarafından muayene edileceği Frankfurt Akıl Hastanesine getirildi, 8 Nisan 1906da bu hastanede öldü. Auguste D.nin ölümünü duyan ve o sırada artık Münihte olan Alzheimer eski çalışma arkadaşlarından klinik kayıtlarını ve beyin dokusunu rica etti. 4 Kasım 1906da Tübingendeki Güneydoğu Alman Psikiyatri Derneğinin 37. Toplantısında Auguste D.nin klinik ve nöropatolojik bulgularını "Über einen eigenartigen, schweren Erkrankungsprozess der Hirnrinde (Serebral Korteksin Sıradışı, Ağır Hastalık Süreci Üzerine)" isimli 11. bildiriyle olgunun adını anmadan sundu. Alzheimer, beynin nöropatolojik incelemesinde serebral korteksin normale göre incelmiş olduğunu gördü. Ayrıca, daha sonra senil plaklar (SP) ve içerdikleri materyel anlaşıldıktan sonra amiloid plaklar (AP) olarak adlandırılacak miliyer odakları ve yine daha sonra nörofibriler yumaklar (NFY) adını alacak intraselüler fibril birikintilerini tanımladı. Bir yıl sonra 1907de bu olguyu yine adını anmadan yayınladı. Aynı laboratuvardan Perusini 1909 yılında aynı nöropatolojik bulguların saptandığı bu kez dört olgu bildirdi. Bunların bir tanesi Alzheimerin olgusuydu ve Auguste D. ismi ilk kez bu makalede geçti. Perusini ayrıca Alzheimerin önerisi üzerine Auguste D.nin serebrovasküler sistemini de inceledi ve kayda değer bir arteriosklerotik değişiklik olmadığını bildirdi. Auguste D.nin 92 yıl sonra APOE genotipi ε3/ε3 bulunacaktır. Volga Almanları ile aynı bölgeden olması nedeniyle bu grubun taşıdığı en sık mutasyon olan PSEN2 N141I mutasyonu taşıması ihtimali araştırılmış ama gösterilememiştir. Sonrasında Müller ve arkadaşları tarafından PSEN1 F176L mutasyonu bulunmuşsa da Rupp ve arkadaşları bu mutasyon da dahil bilinen herhangi bir familyal AH mutasyonunu gösteremediklerini bildirmişlerdir. Hocası ve çalışma arkadaşı, Emil Kraepelin, Psychiatrie: Ein Lehrbuch für Studierende und Aerzte adlı döneminin ünlü psikiyatri ders kitabının 1910daki 8. baskısında Alzheimerin adını anarak ilk kez Alzheimer hastalığı terimini kullanmıştır. Alzheimer 1911de öncesinde üç yıl Kraepelinin kliniğinde yattıktan sonra 56 yaşında ölen Johann F. olgusunu bildirdi. Enteresan biçimde yumaklar olmaksızın sadece plakların görüldüğü (sadece-plak demans) ailesinde çok sayıda 30 ila 60 yaşında hastalık başlangıçlı demans olgusu mevcuttu. Dolayısıyla, Johann F. bildirilmiş ilk familyal Alzheimer hastalığı olgusudur. Sonradan yapılabilen genetik analizlerinde APP geninindeki sınırlı analizde bir mutasyon saptanmamış, APOE genotipi ε3/ε3 bulunmuştur.
İlginç olan, o tarihte Kraepelinin Oskar Fischerin adını hiç anmamış olmasıdır. Başka koşullarda Alzheimer-Fischer hastalığı olması gereken bu hastalıkta Fischerin adının tümüyle unutulmuş olmasının trajik sayılabilecek bir öyküsü vardır. Fischer, Arnold Pickin yönetimindeki Prag Laboratuarındandır. O tarihlerde Münih ve Prag Laboratuarları arasında ciddi bir rekabet olduğu tahmin edilebilir. Bu rekabet ve Kraepelinin Alzheimer ile yakın dostluğu hastalık adı için tercihini açıklayabilir. Diğer yandan alanda Fischerin adının tümden unutulmuş olması sadece Kraepelinin bu tercihi ile ilintili olmasa gerekir. Fischer Alzheimer ile aynı yıl ilk yayınını yaparak 1907de 16 senil demans otopsisinin 12sinde nöritik plaklar tanımladı. Bu makale aynı zamanda kontrol grupları olarak 10 psikoz, 45 nörosifilis ve 10 sağlıklı birey içermekteydi. Bu makale ile ilk kez AP ve nöroenflamasyon ilişkisine değinilmiştir. Fischer, Kraepelinin kitabının 8. baskısının yayınlandığı 1910 yılındaki ikinci makalesinde bu kez farklı hastalıklardan otopsileri yapılmış 275 beyin içinde tümü de 50 yaşın üzerinde 56 olguda plaklar ve bunların bazılarında aynı zamanda yumaklar gördü. Plakların kendi tanımı olan presbyofrenik demansın nedeni olduğunu ileri sürdü. Çok hafif belirtileri olan veya hiç olmayan olgular için yeterince yaşasalardı presbyofrenik demansın tüm belirtilerini göstereceklerdi yorumunu yaptı. Alzheimer 1911 yılındaki makalesinde Johann F.in beyninde Fischer plaklarından söz etmiştir. Fischer 1912 yılındaki üçüncü makalesinde bu kez 35 sağlıklı yaşlı beyninin ikisinde plaklar bulmuş ve bunları presemptomatik olgular olarak tartışmıştır. Fischerin plaklarla ilintili olarak günümüzün sıcak konuları olan gerek pre-semptomatik evre ve gerekse de nöroenflamasyonu öngörmüş olması, makalelerindeki olgu sayıları ile birlikte katkısının büyüklüğünü yansıtmaktadır. Diğerleri arasında Goedert hastalığın adının neden her şeye rağmen Alzheimer-Fischer hastalığı haline dönüşmediğini tartışırken Kraepelinin tercihinin yanısıra, Alzheimer ve Fischer arasındaki tartışmaya, bu tartışma verimli bir iş birliğine dönüşme ihtimali varken Alzheimerin 1915 yılındaki erken ölümüne ve giderek Alzheimerin lehine, Fischerin aleyhine dönüşen dönemin sosyo-politik koşullarına değinir. Alzheimerin her iki olgusu da yaşları nedeniyle pre-senil demans olarak sınıflanırlar ve plaklar ile yumaklar bu yeni tanımlanan hastalığın (AH) patolojik ayırıcı özellikleri olarak kavranır. Fischerin vurgusu plaklar üzerindedir ve bunu senil demanstan farklı olarak tanımladığı presbyofrenik demans ile ilişkilendirmiştir. Bu ezoterik tanım zaman içinde unutulmaya yüz tutacaktır. Oysa ki, Alzheimer ve Fischerin kendi tanımladıkları durumların birbirlerinden farklılığı konusundaki titizliklerine rağmen uzunca bir süre pratik olarak yer değiştirilebilir isimler olarak kullanılacaklardır. Goedert ilk baskısını 1916da yapmış olan dönemin diğer bir psikiyatri ders kitabı klasiği olan Eugen Bleulerin Lehrbuch der Psychiatriesini örnek vererek, kitabın 1949daki sekizinci baskısında Alzheimer Hastalığı başlığında parantez içinde ve O. Fischerin Presbyofrenik Demansı yazarken 1955teki dokuzuncu baskıda bunun düşmüş olduğunu ve aynı başlık altında presbyofreninin unutulmuş bir kavram olduğunun yazıldığını söyler. Fischer, Pragın Alman Yahudilerindendir. II. Dünya Savaşı ve sonrasında yükselen Çek ve Alman milliyetçiliği, izleyerek Nazi tehdidi ve sonrasında işgali altında bir yaşam sürmek zorunda kalacak olan Fischer profesör olarak atanabileceği bir pozisyon bulamaz ve özel çalışmak zorunda kalır. Nazi işgalinde nihayet SS tarafından tutuklanır ve Theresienstadt toplama kampında 1942 yılında ölür. Bu koşullarda Pragın Alman Üniversitesinin laboratuarı Pick ile yakaladığı parıltısını kısa zamanda yitirirken, Münih Laboratuarı Kraepelin-Alzheimer-Spielmeyer çizgisini sürdürerek günümüzde Max-Planck Psikiyatri Enstitüsüne dönüşmüştür.
Sıra dışı olan bunca yaygın bir hastalığın resmen kabul gören ilk iki olgusunun günümüzde atipik olarak sınıflanacak olgular olmalarıdır. Gerek erken başlangıç ve gerekse de aslında erken başlangıçlı AH olgularında aykırı olmayacak şekilde, davranışsal belirtilerin ön planda olduğu klinik tablo Alzheimer tipi demansın (ATD) tipik klinik tablosu değildir. Dahası Johann F. nöropatolojik olarak da atipiktir. AHnin 1970lerin ortalarına kadar Pre-senil demanslar kategorisi altında Pick hastalığı (PiH) ile birlikte nadir hastalıklardan biri olarak sınıflandırılması büyük ölçüde bu nedenledir. Bu nedenle açıklanabilecek şekilde Alzheimerin ölümünden 1970lere kadar AH araştırmalarında kayda değer bir şey olmayan bir karanlık çağ olduğu söylenebilir. Belki tek istisna Belçikalı Divrynin 1927 yılında senil plakların dokularda biriken amiloide affinitesi bilinen Kongo kırmızısına reaksiyon verdiklerini ve plakların merkezi çekirdeklerinin amiloid gibi davrandıklarını söylemesidir. Karanlık çağ geçen yüzyılın son çeyreğinde, aslında çok daha sık görülen ve organik psikoz, kronik organik beyin sendromu, arteriosklerotik demans ya da serebral skleroz gibi adlar da verilen senil demansın AH ile aynı patolojik değişiklikleri paylaşan bir ve aynı antite olduğunun sonunda kavranmasıyla sona erecektir. Robert Katzmanın 1976da senil demans AHdir demesiyle AH tarihinin modern çağına geçilmiş olur. AH tarihinde 70 yıl sonra bir dönüm noktasını temsil eden bu çığır açıcı editoryalde Katzmanın bu kesin ifadeye ulaşmasını sağlayan birkaç yayından söz edilmelidir. Newcastle, İngiltereden Tomlinson, Blessed ve Roth 1968 ve 1969da bir yıl arayla iki otopsi serisi bildirdiler. İlkinde entellektüel bozukluk olmadan ölmüş 28 yaşlı beyinde sınırlı miktarda senil demans (SD = SPler, Alzheimer NFY değişiklikleri, granulovakuolar dejenerasyon) ve arteriosklerotik demans (ASD) değişiklikleri (ASD = serebral yumuşama) görülebileceğini bildirdiler. Bu kognitif olarak normal kişilerde saptanabilen SPler neokortekse, NFYler hippokampusa sınırlıydı. Yazarların senil demansın nöropatolojik karşılığı olarak bir triaddan söz etmeleri, bu triadın içinde plaklar ve yumakları birbirlerinden ayırıp plaklar ve Alzheimerin nörofibriler değişiklikleri terimini kullanarak sadece yumakları Alzheimerin ismiyle ilişkilendirmeleri örtük bir Fischer bağlılığı çağrıştırmaktadır. İkinci makalede bu kez demanslı 50 yaşlı beynindeki bulgularını bildirdiler. Bugün artık granulovakuoler dejenerasyonun (GVD) SP ve NFY ile birlikte bir triad oluşturan bağımsız bir üçüncü nöropatolojik gösterge olmadığını ve bunların tau patolojisine eşlik eden nöron membranına bağlı lizozomal yapılar olduklarını biliyoruz. Olguların yarısı SD triadı gösterirken sadace %12si ASD uyumlu serebral yumuşama sergilemekteydi; karma demans (SD+ASD) sıklığı, kuşkulu olgular da katıldığında %18e kadar ulaşmaktaydı. Yazarlar arteriosklerotik demans tanısının aşırı konulduğu uyarısıyla bitirmekteydiler. Bu o dönem için çok önemli bir adım olsa da hemen peşi sıra atılması gereken diğer adımı atmadılar: apaçık Alzheimer nöropatolojik değişiklikleri ile tanımladıkları SDnin aslında Alzheimer hastalığı olduğunu ifade etmediler. Katzmanın editoryalindeki ilk referansı Katzman ve Karasu kitap bölümüdür. Tokgöz Bayram Karasu New York Albert Einstein Üniversitesinde Türkiyeli bir psikiyatrdır. Katzman ve Karasunun Alzheimer hastalığının senil formunun ABDdeki ölümlerin 4. veya 5. nedeni olarak hesapladıklarını söyleyen Katzmanın Editoryalinin başlığı Alzheimer Hastalığı Büyük Bir Katildir. Yazıyı Tomlinson, Blessed ve Rothun atmadıkları son adımı atıp tereddütsüz bir ifadeyle bitirir: Alzheimerin hem senil hem de pre-senil biçimleri tek bir hastalıktır.
Alandaki herkes bu adımın atılmasını beklemiş olmalılar ki Katzmanin ifadesi şaşırtıcı bir hızla, neredeyse derhal kabul görür. Bu kabul alanda bir paradigma değişikliği etkisi yaratır. Alzheimer anahtar kelimesi ile PubMed veritabanında bir araştırma yapılarak son yarım yüzyılın 10ar yıllık dilimlerindeki yayın sayısına bakıldığında bulunan nerdeyse logaritmik artış çok çarpıcıdır: 1960-69: 28, 1970-79: 327, 1980-89: 5.464, 1990-99: 17.328, 2000-09: 29738, 2010-2019: 55.362. Bu makale sayılarındaki dilimsel üssel artışlarla da açıkça görülebilecek olan AH araştırmalarına ilgi artışı elbette bu araştırmaların fon desteklerinde de üssel artışlarla paraleldir. Nitekim geçen yüzyılın son yirmi yılında hastalığın nörobiyolojik mekanizmalarının, epidemiyolojisinin, klinik ve genetik özelliklerinin büyük ölçüde aydınlatıldığına ve 90 yıl sonra onaylanmış ilk farmakolojik tedavisine tanık olunur. Dahası AH araştırmaları yalnızca bu alanın özeline hizmet etmekle kalmaz giderek bütün nörodejeneratif hastalıklar araştırmaları için bir lokomotif haline gelir, klinik nöropsikoloji, kognitif nörobilim gibi komşu disiplinlerin itici gücü olur.
Aslında AHnin 1976da başlayan modern çağını 30 yıl kadar süren bir erken dönem ve 2007de başlatılabilecek ve hala içinde olduğumuz bir geç dönem olarak ikiye ayırabiliriz. Geç dönemi erken dönemden ayıran temel özelliğin, bu evrede tanık olunan baş döndürücü gelişmelere rağmen ağır bedeller ödenmesine, çok fazla zaman kaybedilmesine de neden olan, birbirleriyle zorunlu etkileşim halindeki iki majör engelin geç döneme geçilmesiyle aşılması olduğu ileri sürülebilir. Bu engellerden ilki AHyi bir demans hastalığı olarak tanıyıp sınıflandırmak, ikincisi bu benzersiz çifte proteinopati hastalığında iki protein arasındaki nedensel ve zamansal ilişkiyi yeterince kavrayamamaktır. Bir hastalığın üzerinde bilimsel olarak çalışılabilmesi için onu yüksek duyarlılık ve özgüllükte tanıyabilecek, benzer durumlardan yüksek bir ayrım gücüyle ayırt edebilecek tanı kriterlerine ihtiyaç duyulur. İdeal tanı kriterleri klinik tanının duyarlılık ve özgüllüğünü arttıran laboratuar yöntemlerini (biyoişaretleyiciler-Bİ) de içerir. Erken dönemin başlarında bu ihtiyacı karşılayan klinik tanı kriterleri geliştirilmişse de Bİler ancak dönemin sonlarına doğru erişilir olmuştur. Bu nedenle ilk tanı kriterlerinde AH için sadece klinik sendromlar tanımlanabilmiştir. Erken dönem tanı kriterleri AHnin başlangıç ve seyrini sinsi ve yavaş ilerleyici olarak tanımlar, ancak klinik tablo için demans tarz ve şiddeti (günlük işlevselliği bozmuş çoğul kognitif bozuklular) temel kriterdir. Bu iki kriterin bir arada bulunması, doğal olarak hastalığın demans aşamasına ulaşmadan önce çok uzun yıllar süren aşamasını bir hastalık olarak kabul etmeyen, mantıksal olarak bir terimler çelişkisi olarak kabul edilmesi gereken bir durumdur. Bugün artık bu sinsi başlayıp yavaş ilerleyen hastalığın ancak yirmi yıl kadar sonra demans aşamasına ulaştığını, bir pre-demans klinik evreden de önce bir pre-klinik evresinin olduğunu biliyoruz. Geç modern döneme kadar AHnin ilk 100 yılı hastalığın etyopatogenezinde sonradan bir çifte proteinopati oldukları anlaşılan plak ve yumakların nedensel rolleri olup olmadığı, eğer varsa hangisinin tetik çekici olduğu, hangisinin bir epifenomen olduğu tartışmalarıyla geçmiştir. Erken modern döneme aslında doğru bir teori olan amiloid kaskad hipotezi ile girilmiş olsa da ilk engelin bu ikincisi üzerindeki kaçınılmaz etkisi, demanslı hastalardan oluşan anti-amiloid stratejili milyonlarca dolarlık klinik çalışmaların birbiri ardına hüsranla sonuçlanması ile ödenen ağır bedeldir. Bugün artık amiloid birikiminin çok uzun yıllar süren pre-klinik evrede tamamlandığını, serebral amiloidozun belli bir aşamasında tetiklenen geri çevrilemez hiperfosforile taunun nöron ölümüne neden olarak klinik belirtileri başlattığını biliyoruz. Geç modern dönemin başlangıç tarihi olarak Uluslararası Çalışma Grubunun (IWG) ilk kez klinik tablo için demans koşulunu ortadan kaldıran, tanıda Bİleri de devreye sokan, ilk yazarın adıyla Dubois Kriterleri olarak da anılan 2007 alınabileceği gibi, pre-klinik evrenin de tanımlandığı, yine ilk yazarının adıyla Sperling Kriterleri olarak da anılan 2011 tarihi de alınabilir. Burada AHnin 1976 sonrası modern çağı olarak anılan dönemdeki gelişmeler ilgili bölümlerde ayrıntılarıyla tartışılacaktır.
KLİNİK TABLO
Terminoloji
AH tipik olarak 65 yaş üzeri bir bireyde, sinsi başlangıçlı, yavaş ilerleyici seyirli, en baştaki sübjektif bellek yakınmalarının sonra objektif olarak saptanabilen izole progresif bellek bozukluğuna dönüştüğü, zaman içinde diğer kognitif alanlardaki bozuklukların da eklendiği ve nihayet zihinsel bozukluğun şiddetinin günlük yaşam aktivitelerindeki (GYAlar) bağımsızlığı da engelleyerek işlevselliği bozar hale geldiği bir klinik tablodur. İşlevsel bozukluk eşiği aşıldığında, kendi içinde hafif, orta ve ağır olarak alt evrelere ayrılan AH demansı (AHD) aşamasına geçilmiş olur. Bu eşiğe kadar olan seyir hafif kognitif bozukluk (mild cognitive impairment MCI) veya prodromal AH olarak adlandırılır. Prodromal AHnin tipik özelliği olan izole progresif bellek bozukluğu amnestik MCI (aMCI) olarak adlandırılır. AH klinik belirtilerini vermeden önce uzun yıllar süren ve bu sırada sadece hastalığın patolojik özelliklerinin evrildiği ve pre-klinik AH adı verilen bir başlangıç evresine sahiptir. Sübjektif bellek yakınmaları halen pre-klinik evrenin son aşamaları olarak değerlendirilmekte ve sübjektif kognitif bozukluk (subjective cognitive impairment SCI) olarak adlandırılmaktadır. Pre-klinik ve klinik evreler patolojik AH (AH-P) ve klinik AH (AH-K) olarak da adlandırılmaktadır. Tipik hastada aile öyküsü negatiftir, yani hastalık sporadik olarak ortaya çıkar. Tipik AH tüm AH olgularının yaklaşık %90ından sorumludur. Bu tanımla uyumsuz erken başlangıç (65 yaş altı erken), hızlı seyir, bellek dışı klinik sunumlar, pozitif aile öyküsü atipik olarak değerlendirilir. Erken başlangıçlı sunum, EOAD (early-onset Alzheimers disease) olarak adlandırılır ve ağırlıkla genetik nedenselliğe sahiptir. Bu nedenle EOAD sınıfında aile öyküsü pozitif ailesel AH (FAH) olguları sıktır. Tipik geç başlangıçlı sunum ise LOAD (late-onset Alzheimers disease) olarak adlandırılır ve yukarda söz edildiği gibi bu sınıf başlıca sporadik AHlilerden oluşur. AH seyri bazen Creutzfeldt-Jakob hastalığını taklit edecek kadar hızlı olabilir. Böyle olgular hızlı progresif AH (hpAH) olarak sınıflanır. Bir hasta başlangıç yaşı, seyir hızı ve ailevi özellik açılarından atipik olabilse de atipik AH terimi başlıca bellek dışı klinik sunumlar için kullanılır.
Tanı Kriterleri
Alzheimer Hastalığı tanısı için 2011 yılına kadar Dünya Sağlık Örgütünün Hastalıkların Uluslararası Sınıflaması dizisinin (ICDler) yanısıra 1984ün NINCDS-ADRDA (National Institute of Neurological and Communicative Disorders and Stroke-Alzheimers Disease and Related Disorders Association) ve Amerikan Psikiyatri Birliğinin (APA) DSMler dizisi (Diagnostic and Statistical Manual of Mental Disorders) tanı kriterleri kullanılmaktaydı.
1948 tarihli DSM-I ve 1966 tarihli DSM-IIdeki kronik organik beyin sendromu tanımı 1980 tarihli DSM-IIIte primer dejeneratif demans, 1987nin DSM-III-Rında (revize DSM-III) Alzheimer tipi primer dejeneratif demans haline dönüştükten sonra bu terim 1994ün DSM-IVünde yaygın kabul görecek Alzheimer tipi demans (dementia of Alzheimer-type DAT) oldu ve aynı terim 2000in DSM-IV-TRında da korundu. Her iki tanı kriterleri dizisi de biri bellek olmak üzere en az iki kognitif alanda sinsi başlangıçlı, yavaş seyirli bir bozulmayı Alzheimer demansı tanısı için zorunlu tutmaktadır. GYAların bozulması DSM-IV için zorunlu kriterken, NINCDS-ADRDA için destekleyici bir kriterdir. Böyle bir tabloya yol açabilecek sekonder nedenlerin (sistemik, nörolojik, psikiyatrik) ekarte edilebiliyor olması da her ikisi için zorunlu dışlama kriteridir. Bu koşulların gerçekleştirildiği tipik tabloya, yukarda söz edildiği gibi DSM-IV ve DSM-IV-TR DAT adını verirken, NINCDS-ADRDA için ise aynı tablonun adı muhtemel Alzheimer hastalığı (probable Alzheimers disease - PRAD) olmaktadır. Sekonder nedenlerin varlığı veya bellek dışı sunum gibi atipik özelliklerin mevcudiyetinde ise mümkün Alzheimer hastalığı (possible Alzheimers disease PosAD) tanısı konulmaktaydı. Özellikle 1990lardan itibaren Alzheimer-dışı demansların tanı kriterlerinin de devreye sokulmaya başlanmasıyla öncesindeki düşük özgüllük de bir ölçüde kompanse edilmiştir. Her iki sisteme göre de kliniko-patolojik serilerdeki tanı duyarlılığı %66-98, özgüllüğü %54-88 arasında değişmektedir. Görüntüleme, EEG ve lomber ponksiyon gibi laboratuvar yöntemleri sadece dışlama tanısı için gerekmekteydi. Kesin Alzheimer hastalığı tanısı ancak biyopsi ya da otopsiyle histopatolojik olarak bir nöropatolog tarafından konulabilmekteydi.
1990larda başlayan ve 2000den itibaren çok hızlanan hastalığın nörobiyolojisinin kavranmasındaki gelişmeler, doğrudan etyopatogenetik mekanizmaları hedefleyen nedene yönelik tedavilerin araştırılabilir olmasına olanak sağladı. Bu amaçla sınanan ve büyük maddi kaynaklar ayrılarak yapılan klinik çalışmaların olgun aşamalarına kadar gelebilen çok sayıda molekül, nihai engelde takılarak ipi göğüsleyemedi. Bu üst üste hayal kırıklarının nedenleri arasında mutad çalışma tasarımından kaynaklanan nedenler ve etkisizliğin yanısıra kuvvetle muhtemel bir diğeri ise bu klinik çalışmaların anılan kriterlerle tanı konmuş demans evresindeki hastaları toplaması gibi görünüyor; oysaki yerleşmiş demans aşaması, doğrudan bir etyopatogenetik mekanizma basamağını hedefleyen bir ajanın gerçek potansiyelini sergileyebilmesi için çok geç kalınmış bir aşama olabilir. AHnin demans aşamasını kanserin metastatik aşamasına benzetip tedavi başarısı beklentisi açısından bir analoji kurabiliriz. Ayrıca bu tanı kriterlerinin AHyi diğer progresif kognitif bozukluklardan ayrım duyarlılığının her şeye rağmen düşük olması ve ilerleyen yıllarda daha iyi anlaşılacak olan non-amnestik atipik formları tanımaması da klinik çalışmaların başarısızlığına katkıda bulunan nedenler gibi görünmektedir. Bu nedenle AHnin daha demans öncesi aşamada güvenilir bir şekilde ayırt edilmesi, AH kesin tanısının bizzat klinisyen tarafından konulması giderek önem kazanmaya başladı.
AH-P klinik olarak demans gelişmeden, hatta AH-Kdan yıllar önce ortaya çıkmakta, demans bu patoloji için ancak son dönemi temsil etmektedir. AH patofizyolojisi sadece tipik bellek sunumuna değil atipik klinik sunumlara da yol açabilir. Ayrıca geçen sürede AH dışı demansların da daha iyi anlaşılması AHnin daha iyi ayrılmasını sağladı. Bu kavrayışlarla birlikte tanı için hastalığa özgü nörogörüntüleme bulgularının tanımlanması ve beyin-omurilik sıvısında AHye spesifik protein düzeyi ölçümlerinin kullanılmaya başlanmasıyla laboratuvar artık bir dışlama yöntemi olmaktan çıktı ve AH hem klinik hem de laboratuvar özellikleriyle (AH Bİleri) tanımlanabilir hale geldi. Bu nedenle yeni tanı kriterleri geliştirilme ihtiyacı doğdu.
İlk müdahale 2007 yılında NINCDS-ADRDA kriterlerinin Uluslararası Çalışma Grubu (International Working Group - IWG) tarafından revize edilmesiyle yapıldı. Revize kriterler sadece PRAD tanısı içindi ve PosAD dahil edilmemişti. PosADın dahil edilmeme tercihi nedeniyle NINCDS-ADRDAde PosAD tanısı alabilecek bütün durumlar (atipik seyir veya klinik sunum, karma durumların varlığı) IWGde otomatik olarak dışlama kriterleri olmaktaydı. IWG çekirdek klinik kriterler ve destekleyici özelliklerden oluşmaktaydı. Çekirdek kriterler izole veya başka bozukluklarla bir arada olabilecek progresif epizodik bellek bozukluğunu içermekteydi. Epizodik bellek bozukluğunun ipucuyla düzelmeyen limbik tarzda olması gerekliliğine vurgu yapılmaktaydı. Manyetik rezonans görüntüleme (MRG) ile görsel değerlendirme ölçeği kullanarak gösterilen mediyal temporal lob atrofisi, FDG-PET ile temporo-parietal hipometabolizma, BOSta düşük Aβ42 veya artmış total tau veya artmış fosfo-tau düzeyleri veya her üçü birden PRAD tanısı için destekleyici özellikler olarak eklenmişti. Kesin AH tanısı için histopatolojik doğrulama geçerliliğini korumaktaydı. Bununla birlikte bir yenilik olarak PRAD tanı kriterlerini dolduran bir hastada Mendelyen mutasyonlardan birinin (APP, PSEN1 veya PSEN2) varlığı tanıyı kesin AH yapmaktaydı. AHnin demansla değil de pozitif Bİler destekli ilerleyici bellek bozukluğuyla eşlenmesi ve mutasyon taşıyıcı tipik kliniğe sahip hastalarda kesin tanıya izin vermesi IWG kriterlerinin getirdiği en büyük yeniliklerdir. Bununla birlikte atipik sunumların dışlanması, pre-klinik evrenin unutulmuş olması da en büyük eksiklikleridir diyebiliriz.
2011 yılında NINCDSin yerini alan Ulusal Yaşlılık Enstitüsü (National Institute on Aging-NIA) ve adını kısaltmış olan Amerikan Alzheimer Derneği (Alzheimers Association-AA) NIA-AA çalışma grubu olarak yeniden bir araya geldiler. NIA-AA çalışma grubu üç alt gruba ayrılarak AH-K evreleri olan MCI ve demans ve asemptomatik AH-P veya pre-klinik AH için üç ayrı tanı kriterleri seti önerdiler (Tablo 1A, 1B, 1C ve 1D). Böylelikle AHyi demans ile eşleyen paradigmaya kesin olarak son verilmiş oldu ve hastalık pre-klinik evreyi de kapsayan bir süreklilik olarak yeniden kavramsallaştırılmış oldu. Bu süreklilikte evreler arası geçişler biyolojik nitelik değişikliklerini değil fakat klinik gözleme dayanan ister istemez konulmuş keyfi eşiklerin aşılmasını temsil etmektedir (pre-klinik evreden MCI evresine geçişte objektif bellek bozukluğu, MCI evresinden demans evresine geçişte işlevsel bozukluk, bu bozuklukların tanımlanma biçimine [örn., kaç standard sapma düşüş bozukluğa karşılık gelir?] ve bozukluğun saptanmasında kullanılan enstrümanların seçimine göre değişecektir). Bu kriterlerde AH-K çekirdek kriterleri genel pratikte de kullanım için ayrılmışken AH-P ve AH-K iki evresi için Bİlerin kullanımı araştırma amaçlı olarak ayrılmıştır. MCI için çekirdek kriterler bizzat hastanın kendisi, hasta yakını veya yakından izleyen hekim tarafından ifade edilen bozulmuş kognitif yetenekler ile beş kognitif alanda (yani, bellek, yürütücü işlevler, dikkat, dil ve görsel-mekansal yetenekler) bir veya daha fazla, işlevsel bozukluğa yol açacak şiddette olmayan objektif bozukluğu içermektedir. Demans için çekirdek kriterlerde ise dördü kognitif, biri davranışsal toplam beş alanın en az ikisinde işlevsel bozukluğa da yol açmış bozulma bulguları demans sendromu tanısı için gereklidir. Bu şekilde demans tespit edilmiş bir hastada sinsi başlamış ve aşikar kötüleşmenin ifade edildiği bir seyir ile klinik olarak tipik amnestik sunum yanısıra bu kez dil, görsel-mekansal veya yürütücü işlev bozukluğu gibi atipik non-amnestik sunumlar da NINCDS-ADRDAden farklı olarak, PRAD tanısına olanak vermektedir. Demans tanı kriterlerinde PosAD tanısı, atipik seyire veya karma durumların (serebrovasküler hastalık, LCD özellikleri gibi) varlığına sınırlandırılmıştır. Bİler iki ana gruba ayrılırlar: 1. Amiloid-beta (Aβ) birikimi işaretleyicileri, 2. Nöronal hasar işaretleyicileri. 1. grup beyin-omurilik sıvısında (BOS) düşük Aβ42 düzeyi ve/veya pozitron emisyon tomografisi (PET) ile amiloid görüntülemede beyinde amiloid birikimi delillerini içerir. 2. grup içinde BOSta artmış total tau ve fosfo-tau düzeyleri (kriterlerin yayınlandığı 2011de PET ile tau görüntüleme henüz mümkün değildi), MRG ile kortikal kalınlık ölçümleri ile spesifik anatomik dağılımda gri madde kaybı (yani, lateral ve mediyal parietal, posterior singulat, ve lateral temporal korteksler) ve/veya volümetri ile hippokampal atrofi, FDG-PET ile spesifik anatomik dağılımda metabolik değişiklikler (precuneus ve temporo-parietal hipometabolizma) bulunur. AH-P zamansal seyri içinde 1. grubun daha önce pozitifleştiği bilinmektedir. AH-K evrelerinin her ikisi için de çekirdek kriterleri dolduran bir hastada her iki grubun da pozitivitesi MCI veya demansın AH ilintili olmasını yüksek ihtimalli, sadece birinin pozitivitesi orta ihtimalli, ikisinin de negativitesi ihtimal dışı kılmaktadır. Pre-klinik evrede AH-P sürekliliği üç alt evreye bölünmüştür. Evre 1. Asemptomatik serebral amiloidozis (sadece amiloid pozitif). Evre 2. Amiloid pozitivitesi + sinaptik disfonksiyon ve/veya erken nörodejenerasyon: Amiloid pozitivitesi + nöronal hasar göstergelerinden bir veya daha fazlasının pozitifliği (FDG-PET veya fMRG ile gösterilen sinaptik disfonksiyonun volümetrik kayıptan daha önce başladığına dair deliller vardır). Evre 3. Amiloid pozitivitesi + nörodejenerasyon delilleri + belli belirsiz kognitif bozulma: henüz MCI şiddetine ulaşmamış, normal değerler arasında kalan kognitif performansa rağmen kendi bireysel standartlarının altına düşme (Tablo 1D). Bu tabloya sübjektif kognitif bozulma (SCI) adı da verilir. İlerde biraz daha ayrıntılı tartışıldığı gibi, bu bireylerdeki yakınmalar mevcut nöropsikolojik bellek enstrümanlarıyla objektif olarak saptanamadığı için halen sübjektif olarak adlandırılmaktalar. Eğer bu bireylerin bellek yakınmaları tahmin edildiği gibi yenilik işleme ve örüntü ayırt etme bozukluğundan kaynaklanıyorsa ve bunu örüntüyü tamamlamayla (aşinalıkla) kompanse ediyorlarsa yenilik işlemeyi ve örüntü ayırt etmeyi değerlendirebileceğimiz yeni bellek testlerinin geliştirilmesiyle, SCIlı bireylerin en azından bir kısmının AH-Pden AH-Kya en erken evre olarak kaydırılmaları mümkün olacaktır. Bu üç kriter setinin yayınlanmasından sonra azımsanmayacak sayıda pre-klinik bireyin amiloid negatif+tau pozitif statüde oldukları görüldü. Bu bireylerin uzunlamasına izlemlerinde genellikle AH dışı klinik tablolar geliştirdikleri saptandı ve bunlara kuşkulu non-Alzheimer patoloji (suspected non-Alzheimers pathology SNAP) adı verildi. Bu bireylerin bir kısmı demansa ilerlemeyen aMCI klinik bulguları geliştirirler. Bu hastalarda otopside de APler olmaksızın sadece limbik-paralimbik alanlara sınırlı, AHde görülenlerden farksız NFYler saptanabilmektedir. Eskiden sadece yumak demansı adı da verilen bu tabloya aslında bir demans değil de çok büyük sıklıkla bir non-progresif aMCI olması ve çok ileri yaşlarda görülmesi dolayısıyla primer yaşla-ilintili taupati (primary age-related tauopathy PART) adı verilmiştir. Hem amiloid, hem de tau negatif olan ileri yaştaki MCIlı bir bireyde arjirofilik tahıl hastalığı (argyrophilic grain disease AGD) olabilir.
2014 yılında ise IWG yeniden toplandı ve Bİ kategorilerini ve AH klinik fenotiplerini tekrar gözden geçirerek IWG-2 kriterlerini yayınlandı. Bu kriterlerin öncekinden önemli iki farkı vardır. Öncelikle AHnin tipik ve atipik klinik sunumları için ve karma tipte AH için ayrı ayrı tanı kriterlerinin önerilmiş olmasıdır. Diğeri ise Bİler destekleyici özellikler olmaktan çıkarılmış ve klinik kriterlerle birlikte tanı için zorunlu haline getirilmiştir. PRAD terimi terk edilmiş ve AH-K için üç ayrı terim benimsenmiştir. 1. Tipik AH: Hippokampal tipte ilerleyici bellek bozukluğu izole olabileceği gibi ikinci bir kognitif veya davranışsal bozukluk (MCI veya demans şiddetinde olabilir) da eşlik edebilir. 2. Atipik AH: Üç ayrı atipik klinik sunum (posterior varyant AH, logopenik varyant AH, frontal varyant AH) ve Down Sendromu sunumu dahil edilmiştir. 3. Karma AH: Tipik AHye özgü bellek bozukluğuna eşlik eden serebrovasküler hastalık veya LCDnin klinik ve görüntüleme özellikleri. Bu tanıların konulabilmesi için spesifik klinik fenotipe ek olarak Alzheimer patolojisinin in vivo delillerini gösterecek üç laboratuvar göstergesinden en az birinin varlığı gerekmektedir. 1. BOSta azalmış Aβ ile birlikte artmış total tau veya fosfo-tau düzeyi. 2. Amiloid PET ile amiloid birikimi. 3. AH otozomal dominant (OD) mutasyonlarından biri. IWG-2, IWG için yukarda sıralanan eksiklikleri kapatmış gibi görünse de kolay erişilir olmayan Bİleri tanı için zorunlu hale getirmesi bu kriterlerin rutin klinik pratikte kullanılabilmesini çok zorlaştırmıştır. Diğer yandan, 1. maddede BOS Bİlerinin her ikisinin birden pozitivitesini talep ederken, 2. maddede amiloid PET pozitivitesini ilk maddenin alternatifi olarak kabullenilmesi doğru bir yaklaşım olarak kabul edilemez. Bunun yerine NIA-AA 2011 kriterlerinin yaklaşımı olan serebral amiloidozun iki göstergesi BOS Aβ42 pozitifliği ile amiloid PETte amiloid yükünün saptanmasının eşdeğer görülmesi doğru olurdu. Artık tau-PET de kabul görmüş bir yöntem olduğuna göre 2. madde amiloid-PET ve tau-PET ile artmış ligand tutulumu olarak değiştirilebilir.
Tablo 1A. Bütün demanslar için çekirdek klinik kriterler NIA-AA 2011 (McKhann ve ark., 2011)
|
Bütün demanslar için çekirdek klinik kriterler
1. İş ya da olağan aktiviteler sırasındaki işlevselliğin etkilenmesi, 2. İşlevsellik ve performansın daha önceki düzeylerine göre düşmüş olması, 3. Delirium ya da majör bir psikiyatrik bozuklukla açıklanmaması, 4. Kognitif bozulmanın (1) hasta ve yakınından alınan öykü ve (2) yatak başı mental durum muayenesi ya da nöropsikolojik inceleme gibi objektif bir kognitif değerlendirmeyle gösterilmesi. 5. Kognitif ya da davranışsal bozulma aşağıdaki alanlardan en az ikisini kapsamalıdır: 1. Yeni bilgi edinme ya da hatırlamanın bozulması. 2. Muhakemenin ve kompleks görevlerin yürütülmesinde bozulma, yargılamanın zayıflaması. 3. Görsel-mekansal yeteneklerin bozulması 4. Dil fonksiyonlarında bozulma. 5. Kişilik, davranış ve tutumlarda değişiklikler. |
Tablo 1B. Alzheimer hastalığı demansı için biyoişaretleyicileri içeren NIA-AA kriterleri (McKhann ve ark., 2011)
|
Tanı kategorisi |
AH etiyolojisinin biyoişaretleyici olasılığı |
Aβ |
Nöronal hasar belirteçleri (tau, FDG, yapısal MRG) |
|
|
Muhtemel AH Demansı |
Klinik kriterlere göre |
Bilgi vermez |
Test edilmemiş/ çelişkili/ belirsiz |
Test edilmemiş/ çelişkili/ belirsiz |
|
AH patofizyolojik süreci kanıtıyla |
Orta |
Test edilmemiş/ belirsiz |
Pozitif |
|
|
Orta |
Pozitif |
Test edilmemiş/ belirsiz |
||
|
Yüksek |
Pozitif |
Pozitif |
||
|
Mümkün AH Demansı (Atipik Klinik Sunum) |
Klinik kriterlere göre |
Bilgi vermez |
Test edilmemiş/ çelişkili/ belirsiz |
Test edilmemiş/ çelişkili/ belirsiz |
|
AH patofizyolojik süreci kanıtıyla |
Yüksek ama ikinci bir etiyolojiyi dışlamaz. |
Pozitif |
Pozitif |
|
|
AHye Bağlı Olmayan Demans |
--- |
En düşük |
Negatif |
Negatif |
AH: Alzheimer hastalığı, Aβ: Amiloid beta, BOS: Beyin-omurilik sıvısı, PET: Pozitron emisyon tomografisi, FDG: Florodeoksi glikoz, MRG: Manyetik rezonans görüntüleme.
Tablo 1C. Alzheimer hastalığı -MCI için biyoişaretleyicileri içeren NIA-AA kriterleri (Albert ve ark., 2011)
|
Tanı kategorisi |
Aβ |
Nöronal hasar belirteçleri (tau, FDG, yapısal MRG) |
|
MCI Klinik tanı (Petersen kriterleriyle aynı) |
Test edilmemiş |
Test edilmemiş |
|
MCI orta ihtimalle AHye bağlı |
Pozitif |
Test edilmemiş |
|
Test edilmemiş |
Pozitif |
|
|
MCI yüksek ihtimalle AHye bağlı |
Pozitif |
Pozitif |
|
MCI- olasılıkla AHye bağlı değil |
Negatif |
Negatif |
Aβ: Amiloid beta, BOS: Beyin-omurilik sıvısı, PET: Pozitron emisyon tomografisi, FDG: Florodeoksi glikoz, MRG: Manyetik rezonans görüntüleme, MCI: hafif kognitif bozukluk.
Tablo 1D. Alzheimer hastalığı preklinik evreleri için biyoişaretleyicileri içeren NIA-AA kriterleri (Sperling ve ark., 2011)
|
Kognitif olarak normal (risk altındaki) birey + Biyoişaretleyici pozitifliği Evre I : Aβ Evre II : Aβ + tau Evre III : Aβ + tau + silik kognitif/davranışsal bozulma |
Hastalığın tanısını olabildiğince erken koyabilmek arzusu klinik çalışmaların odağını risk altında fakat kognitif yakınması olmayan ya da kognitif yakınması olan fakat nöropsikolojik testlerle objektif kognitif bozukluk saptanmayan bireylere yönlendirdi. Böylelikle araştırmalarda Bİ kullanımı yaygınlaştı ve AHnin kliniko-patolojik ilişkisinin yerini klinik-biyoişaretleyici ilişkisi aldı. AH artık demansla karakterize bir sendrom olmaktan ziyade zemininde yavaş ilerleyen amiloidoz ve ardından nörodejenerasyonla karakterize bir nöropatolojinin bulunduğu ve klinik olarak asemptomatik evreden demans evresine kadar ilerleyen semptomatik evrelerden oluşan bir hastalık sürekliliği olarak görülmeye başlandı.
Böylelikle 2018 yılına gelindiğinde NIA-AA çalışma grubu özellikle araştırmalarda kullanılacak bir çerçeve çizmek üzere AH için kliniği geri planda tutan biyolojik ağırlıklı bir tanımlama girişiminde bulundu. AH biyoişaretleyicileri amiloid birikimi belirteçleri (A), tau birikimi belirteçleri (T) ve nörodejenerasyon belirteçleri (N) olmak üzere 3 gruba ayrıldı ve AT(N) Bİleri olarak tanımlandılar.
BOSta Aβ42 pozitifliği ya da amiloid PET ile amiloid birikiminin gösterilmesi A pozitifliği, BOSta fosfo-tau pozitifliği ya da tau PET ile tau birikimin gösterilmesi T pozitifliği, anatomik MRGde atrofi ya da FDG-PETte hipometabolizma ya da BOSta total tau pozitifliğinin gösterilmesi (N) pozitifliği anlamına gelmektedir. Bu üç biyoişaretleyici grubuna göre 8 tane biyoişaretleyici profili önerilmiştir (Tablo 2). Her üçünün de negatif olması normal biyoişaretleyici profili (NBİP) anlamına gelirken, diğer ikisinden bağımsız olarak sadece A pozitifliği kişiyi Alzheimer sürekliliği (AS) kategorisine sokmaktadır. A negatif iken diğerlerinden en az birinin pozitifliği ise kişiyi non-AH patolojik değişiklik (NAPD) kategorisine sokar. AS içinde A+T-(N)- durum Alzheimer patolojik değişikliği (APD) adını alır. A+T+(N)+/- iki durum AH olarak adlandırılır. A+T-(N)+ durum ise APD+NAPD olarak karma duruma karşılık gelir. Bu kriterlerde klinik, biyoişaretleyicilerden farklı olarak kognitif evrelemeyle tariflenir ve (C) ile gösterilir. A ve T AHyi tanımlayan spesifik nöropatolojik değişikliklere işaret etmektedir, (N) ve (C) ise AHye spesifik değildir ve bu yüzden parantez içerisinde gösterilmiştir. Kognitif yakınması olsun ya da olmasın objektif kognitif bozukluk saptanmamış bireyler kognitif olarak etkilenmemiş (cognitively unimpaired - CU), demans eşiğini aşmamış fakat objektif olarak kognitif bozulma saptanan bireyler MCI ve GYAları etkiler düzeyde kognitif bozulma saptanan bireyler ise demans (D) evresinde olarak tanımlanmıştır. AT(N) statüleri ile (C) statüleri arasında mütekabiliyetler saptanabilir. Buna göre AS, NAPD ve NBİP statülerinin her biri için CU, MCI ve D durumları mümkündür. AS kendi içinde klinik bozulma şiddetine göre altı evreye ayrılır. 1. Evre: CU. 2. Evre: SCI-CU. 3. Evre: MCI. 4. Evre: Hafif demans. 5. Evre: Orta demans. 6. Evre: Ağır demans.
|
|
Biyoişaretleyici kategorisi |
AT(N) profili |
Kognitif evre |
||
|
Kognitif Olarak Etkilenmemiş |
Hafif Kognitif Bozukluk (HKB) |
Demans |
|||
|
Biyoişaretleyici Profili |
Normal AH biyoişaretleyicileri |
A-T-(N)- |
Normal AH biyoişaretleyicileri, kognitif olarak etkilenmemiş |
Normal AH biyoişaretleyicileri ile birlikte MCI |
Normal AH biyoişaretleyicileri ile birlikte demans |
|
Alzheimer sürekliliği |
A+T-(N)- |
Preklinik Alzheimer patolojik değişikliği |
Alzheimer patolojik değişikliği ile birlikte MCI |
Alzheimer patolojik değişikliği ile birlikte demans |
|
|
A+T+(N)- |
Preklinik Alzheimer hastalığı |
Alzheimer hastalığı ile birlikte HKB |
Alzheimer hastalığı ile birlikte demans |
||
|
A+T+(N)+ |
|||||
|
A+T-(N)+ |
Alzheimer ve eşlik eden şüpheli non-Alzheimer patolojik değişikliği, kognitif olarak etkilenmemiş |
Alzheimer ve eşlik eden şüpheli non-Alzheimer patolojik değişikliği ile birlikte HKB |
Alzheimer ve eşlik eden şüpheli non-Alzheimer patolojik değişikliği ile birlikte demans |
||
|
Non-Alzheimer patolojik değişiklik |
A-T+(N)- |
Non-Alzheimer patolojik değişiklik, kognitif olarak etkilenmemiş |
Non-Alzheimer patolojik değişiklik ile birlikte HKB |
Non-Alzheimer patolojik değişiklik ile birlikte demans |
|
|
A-T-(N)+ |
|||||
|
A-T+(N)+ |
|||||
Tablo 2. Tanımlayıcı terminoloji: Biyoişaretleyicilerle kombine şekilde sendromal kognitif evreleme (Jack ve ark., 2018).
Tanımladığımız AHnin geç modern dönemi büyük ölçüde Bİlerin klinik tanıya katkısı ile belirlenmektedir. Bu nedenle bu dönem içinde devreye girmiş olsalar da kriterleri içine Bİleri dahil etmeyen DSM-V (2013) ve ICD-11 (2019) gibi tanı kriterleri setleri burada tartışılmamıştır.
Alzheimer Hastalığının Evreleri- Alzheimer Hastalığı Sürekliliği
İlerleyici hastalıklar patogenetik süreçleri içinde belli bir eşiği geçtikleri aşamada klinik olarak saptanabilirler. Bu eşik de hemen daima normal kabul edilemeyecek bir belirtidir. Örneğin, glioblastoma yeterince büyüyüp kafaiçi basıncını arttırarak başağrısına neden olana kadar subklinik olarak ilerler. Başağrısı kadar aşikar bir belirti olmayan unutkanlık durumunda subklinik dönemle klinik dönem daha kalın çizgilerle içiçe girer. Unutkanlığın klasik olarak yaşlılıkta sıklıkla duyulmaya alışılmış, gayet normal kabul edilen bir yakınma olması da normal olan ile anormal olanın ayrımını daha da önemli kılmaktadır. Bellek de dahil olmak üzere bazı kognitif yeteneklerde yaşlanmayla birlikte beklenen normal azalma nöropsikolojik standardizasyonda eğitimle birlikte göz önüne alınması gereken temel özelliklerdendir. Bir yakın bellek testinde yetmişli yaşların normal değeri yirmili yaşların normalinin yarısı olabilir. Normal yaşlanma kavramı bellek de dahil kognitif kapasitelerini hiç yitirmeyen küçük bir azınlığı (süper yaşlılar) içerse de, ağırlıkla nöropsikolojik testlerde yaşa göre uyarlanmış düzeylerde bir performansa karşılık gelir. Sosyal yaşamda başka açılardan sağlıklı bir yaşlının özel isimleri unutuyor, özel eşyalarını kolaylıkla bulamıyor olması anormal kabul edilmez. Aynı soruları tekrarlar olması yakınları arasında kuşku uyandırmaya başlar. İşini sürdüremez olması, ya da yabancı bir mekanda kaybolması ise artık normal olarak kabul edilemez olur. Normal yaşlanma için kabul edilebilir bellek bozukluğunu tanımlamak amacıyla Selim Yaşlılık Unutkanlığı, Yaşla İlintili Bellek Bozukluğu (AAMI) kavramları önerilmiş ve 1986 yılında Amerikan Ulusal Zihinsel Sağlık Enstitüsü (NIMH) tarafından araştırma amaçlı tanı kriterleri yayınlanmıştır. Bu tanı kriterlerinde AAMI tanımına uygun düşen yakınmaları olan bir yaşlı günlük yaşamında tümüyle bağımsızdır, nöropsikolojik muayenesinde ise özellikle yakın bellek testlerinde yaşa göre normal sınırlarda, fakat genç erişkinlere göre ortalama değerlerin 1 standart sapma (SD) altında yer aldığı saptanır. Fakat bu ayrım hangi yaşlının selim yaşlılık değişikliklerini gösterdiği, hangisinin ise AHnin en erken izlerini taşımakta olduğu sorularının cevabını verememekteydi. Günümüzde artık SCI kavramı yaygın kabul görmüştür.
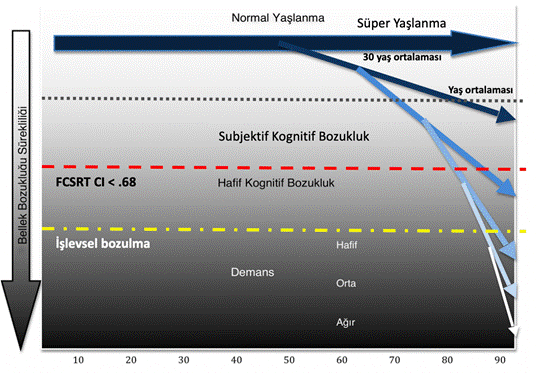
Şekil 1. Normal yaşlanmadan ağır demansa bellek bozukluğu sürekliliği.
Yaşlılıkta pre-demans kognitif bozukluğu tanımlama gayretiyle bir dizi daha kavram ve kriterler dizisi ileri sürülmüş olsa da tümü demansa ilerleyen bir bellek bozukluğu kavrayışından ziyade demans kadar şiddetli olmayan bir hafif kognitif bozukluku çeşitli isimlerle tanımlamışlard. Bunlar arasında 1990lar boyunca tanımlanan ICD-10un minimal kognitif bozukluk MCD, DSM-IVün hafif nöro-kognitif bozukluk MNCD, Uluslararası Psikogeriyatri Birliğinin Yaşla İlintili Kognitif Bozukluk AACD ve Kanada Sağlıklı Yaşlanma Çalışması (CSHA) çerçevesinde kullanılan demans olmayan kognitif bozukluk CIND kavramları sayılabilir. Tüm bu tanımlamalar, belli nüanslarına rağmen, tanımladıkları demans şiddetinde olmayan kognitif bozukluk durumunu esas olarak statik özerk antiteler olarak görmektedirler; öyle ki, bunlar arasından bir kısım hasta düzelip normale dönebileceği gibi, bir kısmı ise ilerleyip demans geliştirdiğinde nitelik değiştirip başka bir antiteye dönüşmüş gibi kabul edilmektedir. İlk kez 1997de Mayodan Ron Petersen ve aralarında Türkiye kökenli Emre Kökmenin de bulunduğu arkadaşları tarafından tanımlanan, MCIda kişi anılan bellek problemlerinin yarattığı, ancak listeyle alışverişe çıkar olmak gibi genellikle üstesinden gelebildiği güçlükler dışında, günlük yaşamında halen bağımsızdır. Nöropsikolojik muayenesinde ağırlıkla bazen de tek başına bellek alanında, anlamlı düzeyde düşük performans gösterir. Orijinal biçimiyle bu tanım, prodromal AH olması muhtemel, ATDye dönüşme riski taşıyan bir alt grubu araştırma ve mümkünse tedavi hedefi yapmak üzere belirlenmişse de sonradan revize edilen biçimiyle amnestik olmayan demanssız kognitif bozukluklar da dahil edilerek prodromal AHye olan vurgu çabası kapsayıcılık adına zayıflamış görünmektedir. Sınıflama tümüyle bellek bozukluğunun bulunup bulunmamasına ve mevcut kognitif bozukluğun tek veya çoğul olma durumuna göredir. Bu farklı tabloların ilerledikleri takdirde en mutad olarak belli demans hastalıklarına dönüşecekleri beklenir. İlk bakışta bu sınıflama yukarda tanımlanan çekirdek sendromlar yaklaşımının bir benzeri gibi düşünülebilirse de buradaki mevcut MCI tablosu-ilerdeki demans sendromu ilişkisi çok daha indirgemeci bir akıl yürütmedir. Çekirdek sendromların anatomik adreslerinden bu anatomik adrese yatkınlık sergileyen en muhtemel proteinopati tarzı bir akıl yürütme esnekliği sergileyemez. Örneğin, progresif simultanagnozi-simetrik dorsal parietal alanlar-amiloidopati + taupati silsilesi progresif simultanagnozinin bu sınıflamadaki karşılığı olan izole non-amnestik MCI ile, bu MCI alt sınıfının AHye dönüşmesi beklenmediğinden sağlanamaz. Dahası, çekirdek sendrom yaklaşımıyla, ilerde demansa dönüşüp dönüşmeyeceğine bakılmaksızın anatomik yatkınlık ve muhtemel proteinopatiden yola çıkarak hastalık tanısına varmak mümkünken, MCI tanımı ile ancak demans aşamasında bir hastalıktan söz edilebilecek durumla normallik arasında kalmış bir geçiş aşaması tasarlanmış olmaktadır.
Uzunlamasına izlenen büyük serilerde bu kriterlerle tanımlanmış MCIın demansa dönüşme hızı yıllık %8-14ken 5 yıllık izlemlerde %50 kadardır. Oysaki, normal popülasyonda demans insidansı %1-2dir.
Yukarıda yapılmış olan tanımlar Alzheimer hastalığını bir süreklilik olarak kabul etmekten ziyade her bir kognitif basamağı ayrı bir antite olarak kabul etmekteydi. Bu da hastalığın nöropatolojik ilerleyişini yansıtmıyordu ve pre-klinik/asemptomatik evredeki hasta grubunu tanımlayamıyordu. Genetik açıdan risk taşıyan bireyler ve sağlıklı yaşlılarda yapılan çalışmalar hastalık patofizyolojisinin yıllar, hatta onyıllar (bazı hesaplamalara göre 15-20 yıl) önce başladığını ortaya koydu. Biyoişaretleyicilerin kullanımını sağlayan gelişmeler sayesinde de bu patofizyolojik süreci in vivo izleme şansı elde etmiş olduk. Gözlenen ilk patolojik değişikliğin Aβ birikimi olduğu, fakat kognitif bozulmanın ancak tau birikimi ve nöron kaybı gelişmesiyle ortaya çıktığı görüşü önem kazandı.
2011 NIA-AA kriterleriyle hastalığın pre-klinik evresi artık asemptomatik ve sübjektif/silik kognitif bozukluk evresi olarak ikiye ayrılırken klinik evrelerine ise henüz demans eşiğine ulaşmamış objektif kognitif bozuklukla karakterize Alzheimer Hastalığına bağlı hafif kognitif bozukluk (AH-MCI) ve ardından Alzheimer Hastalığı demansı dahil olmaktadır (Şekil 1).
Alzheimer Hastalığı Sürekliliği, Pre-klinik Evre
Giderek hastalığın patolojik ilerleyişinin daha iyi anlaşılmasıyla hastalığın erken evrelerde henüz asemptomatik iken tanısının konulabilmesi önem kazanmıştır. Hastalığın pre-klinik evresiyle ilgili bilgiler özellikle genetik açıdan riskli gruplarla yapılan çalışmalardan elde edilmiştir. Pre-klinik evre klinik olarak asemptomatik (AH-AS) ve SCI (AH-SCI) olarak ikiye ayrılmaktadır. Akılda tutulması gereken, bir bireyin AH sürekliliği-pre-klinik evresinde değerlendirilebilmesi için zeminde AH patolojisine dair delil bulunması gerekliliğidir. Fakat bu delil kişide açıkça AH demansı gelişeceğinin kanıtı olarak kabul edilemez. Biyoişaretleyici pozitif fakat kognitif olarak normal kişiler AH demansı için risk altında asemptomatik bireyler olarak tanımlanmaktadırlar.
Tüm bu tanımlar asemptomatik bir birey neden AH açısından değerlendirilmekte ve AH sürekliliği içine dahil edilmektedir? sorusunu akla getirebilir. Bu tanımlara özellikle AH için genetik risk taşıyan gruplarda yapılan çalışmalarla ya da çalışmalarda kontrol grubu olarak incelenmiş bireylerin sonuçlarıyla ulaşılmıştır. Kognitif yakınması olmayan ve nöropsikolojik olarak da kognitif olarak normal bulunan bireylerde de BOS veya PET ile amiloid birikiminin delilleri gösterilmiştir. Bu delilin ne anlama geldiğine dair detaylı bilgiye biyoişaretleyiciler başlığında tekrar değinilecektir.
Bir bireye SCI diyebilmemiz için kişinin kendi normaline göre kognitif/davranışsal bozulma yakınması olması, bu yakınmanın günlük yaşam aktivitelerini etkilememesi ve nöropsikolojik testlerdeki performansının normatif aralıkta olması gerekir. Yukarda da değinildiği gibi yenilik işlemlemeyle ilgili bellek testlerinin rutin nöropsikolojik değerlendirmeye sokulması, muhtemelen SCIlı bireylerin bir kısmını AH-Pden AH-Kya sokacaktır. Kişi kendi kognitif durumundaki değişikliği fark ettiği ve ilerde demansa dönüşme riski konusunda endişe taşıdığı için başvurmuş olabilir. Özellikle AH için genetik açıdan riskli grupta olan bireyler bu aşamada bize başvurabilirler.
NIA-AA kriterlerinde bu pre-klinik evreler biyoişaretleyici pozitifliğine göre sınıflandırılmış ve pre-klinik AH kendi içinde 3 evreye ayrılmıştır (bkz. Tablo 1D).
Bu sınıflamalar araştırmalar için bir çerçeve oluşturmak amacı taşırlar. Pre-klinik evrede AH patolojisi için biyoişaretleyici kanıtı olan bireyler kognitif ve davranışsal bozulma ve ardından demans gelişimi için risk altındadırlar. Fakat AH-P pozitifliği olup yaşam boyu semptom geliştirmeyen bireyler de bulunmaktadır. Otopsi çalışmaları da bunu desteklemektedir. Kognitif açıdan normal kişilerin otopsileri, tümüyle normal olabileceği gibi 50li yaşların başlarından itibaren neokortekste gevşek nitelikli amiloid plaklar ve bazen bunlara eşlik eden entorhinal kortekste NFYlerin görülebileceğini ortaya koymaktadır. Sağduyu bu 2. gruba ait beyinlerde AH nörodejenerasyonun başladığı fakat henüz klinik belirti eşiğini geçmediğini düşündürmelidir. Başka bir deyişle, henüz tam kesin bir bilgi olarak yerleşmemiş bir şekilde, 2. grup değişiklikleri göstermeye başlayan beynin sahibi yeterince uzun yaşasaydı, ya yakınmaları zaman içinde görünür olup sonunda AH klinik kriterlerini doldurabilirdi veya savunma mekanizmalarının direnci sayesinde nöropatoloji sınırlanabilir ve yaşam boyu asemptomatik kalabilirdi. Bu varsayımların ikisi de bir arada kısmen doğru olabilir.
Alzheimer Hastalığı Sürekliliği, Klinik Evre (AH-K)
Hastalığın klinik evreleri henüz demans eşiğine ulaşmamış objektif kognitif bozuklukla karakterize AH-MCI ve ardından AHDdir. Yukarda değinildiği gibi AH-K klinik sunum, başlangıç yaşı, seyir hızına göre tipik ve atipik olarak sınıflanır. Klinik sunum yukarda Çekirdek Sunumlar başlığında ayrıntıyla tartışılmıştır. Tipik klinik sunumun (%90) ilerleyici bellek bozukluğu olması beklenir ve çekirdek sendromlardan progresif amnestik disfonksiyona karşılık gelir. Atipik sunumlar (%10) diğer tüm çekirdek sendromlarla olabilir. Bu sunumlar arasında görsel, dilsel ve frontal varyantlar IWG-2 ve NIA-AA gibi formel tanı kriterlerine de dahil edilmiştir. Formel kriterler içinde anılmamakla birlikte motor varyant ile de azımsanmayacak bir sıklıkta sunulabileceği unutulmamalıdır. Görsel varyant-AH çekirdek sendromlardan progresif görsel-mekansal bozukluka karşılık gelir ve geleneksel olarak posterior kortikal atrofi olarak adlandırılır. Dilsel varyant-AH çekirdek sendromlardan progresif afaziye karşılık gelir ve primer progresif afaziler altında sınıflanan logopenik varyant PPA ile ilintilidir; agramatik/tutuk ve semantik varyant PPAlarda AH patolojisi beklenmez. Frontal varyant-AH çekirdek sendromlardan progresif davranışsal/yürütücü bozukluka karşılık gelir ve en seyrek atipik AH sunumu olsa da dvFTD fenotipinin göreli yaşlı sunumlarında akla getirilmelidir. Motor varyant-AH çekirdek sendromlardan progresif apraksiye karşılık gelir ve kortiko-bazal sendrom alt tipleri arasında temporo-parietal varyant KBS ile ilintilidir; frontal varyant KBSde AH patolojisi beklenmez. Tipik başlangıç yaşının 65+ olması beklenir (LOAD). Terminoloji başlığında değinildiği gibi, 65 yaş altı genç veya pre-senil başlangıç (EOAD) atipik kabul edilir ve genetik faktörleri düşündürür (otozomal-dominant mutasyonlar veya APOE ε4 taşıyıcılığı). AH seyri tipik olarak yıllar içinde yavaş ilerleyicidir. Ancak, yine Terminoloji başlığında değinildiği gibi Creutzfeldt-Jakob hastalığına benzeyen, hızlı ilerleyici bir atipik alt tipi de vardır (hpAH). hpAH hastaları genel olarak MMSEde yılda 6 veya daha fazla puan kaybeden AHli bireyler olarak tanımlanır. Bu hastalarda fokal nörolojik bulgular erken dönemde çoğul olarak belirir. BOS Bİler sıklıkla çok düşük Aβ, çok yüksek fosfo ve total tau düzeyleri şeklindedir. Sağkalım 3 yılın altındadır. Nöropatolojik olarak tipik AH bulgularına orta-ağır düzeyde serebral amiloid anjiyopati (CAA) eşlik etmesi de sık bir bulgudur.
AH-MCI
MCI tipik olarak amnestik ya da atipik olarak non-amnestik olabilir. Amnestik MCIın (aMCI) AHDye dönüşme olasılığı daha yüksektir. NIA-AA kriterlerinde AH-MCI için klinik ve araştırma kriterleri ayrı ayrı tanımlanmıştır. Klinik tanı kriterleri Petersen-Mayo kriterlerinden farksızdır. Hasta veya yakını tarafından ifade edilen ya da klinisyen tarafından gözlenen kognitif bozulmanın varlığı, bir ya da daha fazla kognitif alanda bozulmanın objektif olarak gösterilmesi ve günlük yaşam aktivitelerinin etkilenmemiş olması gerekmektedir. Kognitif yıkıma neden olabilecek başka faktörler dışlanmalıdır.
Klinik olarak MCI tanısı almış bireylerde Bİler kullanılarak altta yatan etyolojiye dair fikir edinilebilir. İlerleyen yıllarda tedavi ajanları kullanıma girdiğinde doğru tedavinin bu şekilde seçilmesi mümkün olabilecektir. Bİ kullanımı kliniğin nasıl seyredeceğine dair de fikir verebilir. Örneğin klinik olarak MCI tanısı almış bir bireyde, NIA-AA kriterlerine göre, amiloid birikimine işaret eden Bİ pozitifliği veya nöronal hasara işaret eden Bİ pozitifliğinden biri mevcut ise, bu bireyin AH-MCI olma olasılığının orta düzeyde olduğunu, her ikisinin birden pozitifliği ise yüksek düzeyde olduğuna işaret etmektedir. Her ikisi de negatif ise bu MCI kliniğinin AH zemininde olma ihtimali zayıftır. MCI otopsilerinde normalden hafif AH patolojilerine kadar değişen bir spektrum izlenmekle birlikte, NFYnin halen limbik-paralimbik alanlara sınırlı ancak sayısal olarak normallere göre anlamlı düzeyde artmış olması en tutarlı bulgu gibi görünmektedir. NIA-AA kriterlerindeki temkinli söylem günümüze MCI klinik tanısının A+T+(N)+ durumda AH-MCI, özellikle de ileri yaşlı MCIlı bireylerde A-T+(N)+ durumda PART, özellikle de MCI tablosuna psikotik bulguların da eşlik etmesi durumunda ileri yaşın bir başka taupatisi olan arjirofilik tahıl hastalığı (AGD), A-T-(N)+ durumda limbik-baskın yaşla-ilintili TDP-43 ensefalopati (LATE) patolojik tanısına karşılık gelmesi şeklinde uyarlanabilir.
Alzheimer Hastalığı Dermansı (AHD)
Aynı klinik özellikler belli bir eşiği aştığında artık kişinin günlük yaşam aktiviteleri de bozulmaya başlayacak ve AHDden bahsedilecektir. Burada da tanı kişinin kendisi, yakını veya hekim tarafından farkedilen kognitif yıkımın varlığı, objektif araçlarla en az 2 kognitif alandaki bozulmanın gösterilmesi ve kognitif yıkımın kişinin günlük yaşam aktivitelerini etkileyecek düzeyde olmasıyla konulur. Bu duruma karşılık gelen otopsilerde NFYler artık neokortekse yayılmış, gevşek biçimden nöritik biçime değişmiş APler limbik sistemde görülür durumdadır.
İlerleyici bir hastalıktan söz ettiğimize göre klinik tabloyu statik bir profille tarif edemeyiz. Yine sağduyu ile amatör bir yaklaşım dahi ilerleyen bir tablonun hafif, orta ve ağır olarak sınıflandırılması gerektiğini öngörebilir. Formel evreleme ölçeklerinin de taklit ettiği yöntem bundan farklı değildir. Zihinsel yıkımın demans düzeyine ulaşması günlük aktivitelerde bozulma ile belirlendiğine göre, evrelemeyi de GYAlara göre kabaca yapabiliriz: SCIyı sübjektif bellek yakınmaları, MCIyı GYAların korunduğu ama yakın kişilerin farkında olduğu bir bellek bozulması olarak tarif etmiştik; bu durumda devamlılık ölçütünü göz önünde tutarak hafif demansı işte ve ev dışında bağımsızlığın bozulmaya başladığı, orta demansı, bunlar tümüyle bağımlılaşırken ev yaşamı ve kendine bakımda sorunların başladığı, ağır demansı ise sürekli bakım gereken, hastanın tümüyle bağımlı olduğu bir durum olarak tarif edebiliriz.
Bugün yaygın olarak kullanılan iki evreleme sisteminden biri olan Global Bozulma Ölçeği (Global Deterioration Scale- GDS)nin de geliştiricisi olan Reisberg, AHdeki ilerleyici yıkım sürecini, bebeklik-erken ve geç çocukluk ve ergenlik şeklindeki insanın ilerleyici bireyselleşme-bağımsızlaşma gelişimsel sürecinin tam tersine çevrilmesi olduğunu ileri sürer ve bu ilerleyici yıkımı retrogenez olarak adlandırır. Buna göre MCIlı yaşlı büyük ölçüde bağımsız olsa da bazı kararları için erişkin gözetimine gerek duyan ergene, hafif demanslı, evinde ve ev dışında tanıdık mekanlarda belli bir bağımsızlığı kazanmış, ancak sosyal ilişkiler, muhakeme gerektiren karmaşık işlevlerde halen denetim gereksinen 7-12 yaşlarındaki ilkokul çocuğunu andırır. Orta demanslı ise kabaca, ev yaşamı ve giyinme, yıkanma, yemek yeme gibi temel GYAlarda henüz gözetim gereken 2-6 yaşları arasındaki okul öncesi çocuğu gibidir. Ağır demanslı, yaşamını sürdürmek için 24 saat ana-babaya (bakıcıya) tümüyle bağımlı 0-2 yaş bebeğine benzer. Ağır evrenin kendisi de, yani giderek tüm motor ve verbal yeteneklerin kaybedildiği yatağa tam bağımlı nihai döneme doğru yıkım, oturma, yürüme, konuşma, sfinkter kontrolünün geliştiği bebekliğin dinamik gelişiminin tam tersi olarak kavranıp alt evrelere ayrılabilir.
GDS söz edildiği gibi AHyi evrelemeye yarayan ölçeklerden birisidir. AH dışı demanslarda AHye özgüllüğü dolayısıyla kullanılamaz. GDS evreleri 1 ila 7 arasında değişir. Kabaca, GDS1 hiç yakınması ve bulgusu olmayan normal yaşlıya karşılık gelirken GDS2ye SCI, GDS3e ise MCI evreleri denilebilir. GDS 4-5-6-7 ise hafif, orta, ağır ve çok ağır olmak üzere AHnin klinik evreleridir. Demansın Klinik Evrelendirilmesi (Clinical Dementia Rating Scale-CDR) ise yaygın olarak kullanılan 2. ölçektir. CDRda bellek yine merkezi önemde olmakla birlikte, çok eksenli tasarımıyla diğer demansların evrelenmesinde de kullanılabilir. CDR evreleri 0-0,5-1-2-3 olarak sıralanırlar. CDR 0, SCIyı da içerecek şekilde normal yaşlılığa karşılık gelir. CDR 0,5 büyük ölçüde MCIya, bazen de çok erken demansa karşılık gelir ve kuşkulu demans evresi adını alır. CDR 1, 2 ve 3 sırasıyla hafif, orta ve ağır evrelerdir.
Hafif evredeki demanslı hasta halen çalışmaktaysa artık işinde verimliliğini yitirmiştir. Yaratıcılık gerektirmeyen tekdüze işler başlangıçta sürdürülebilse de, iş arkadaşları performans düşüklüğünün farkındadırlar ve kısa süre içinde emeklilik kaçınılmaz olur. Yakın geçmişe ait olayların hatırlanmasındaki güçlük, aynı soruların tekrarlanması, kelime bulma güçlükleri yakınların dikkatini çeken başlıca özelliklerdir. Halen bildik mekanlarda dolaşabilse ve yolculuk yapabilse de, yabancı mekanlarda kaybolabilir. Araba kullanırken sinyalizasyona dikkatsizlik, tepkilerde yavaşlama, yönleri karıştırma gibi güçlükler başlamıştır. Banka işleri, fatura ödemeleri gibi mali işlerde hatalar olmaktadır. Banka kartı, cep telefonu gibi yenilikleri öğrenip kullanmayı başaramaz. Hobiler (dikiş-nakış, bahçecilik, sanatsal uğraşılar, yetenek oyunları, vb.) sürdürülemez olmuştur. Yemek lezzetinde bozulmalar gibi mutfak işlerinde güçlükler başlamıştır. Çamaşır, bulaşık gibi ev işlerini sürdürebilse de, bunlarda eski özenini bir ölçüde yitirmiştir. Okumak ve gazete-TV aracılığıyla aktüaliteye ilgi azalmıştır. Giyinmek, yıkanmak, sofra alışkanlıkları ve temel hijyende henüz bir sorun yoktur. İritabilite, duygulanımda küntleşme ve inkar eğilimi ile kendiliğindenliğin azalması dışında davranışsal belirtiler yoktur ve sosyal uygunluk iyi korunmuştur. Uyku kalitesi bozulmaya başlar. Cinsel ilgi ve iştah bozulur. Eksikliklerin farkedilmesinin de katkısıyla bazı olgularda depresyon belirtileri ön planda olabilir. Ancak depresyon sıklıkla keder ifadesi gibi afektif belirtilerden çok, isteksizlik gibi motivasyonel belirtilerle kendini gösterir. Muayenede yakın bellek ön planda olmak üzere, görsel-mekansal bozukluk, uzak bellekte bozulmalar, adlandırma güçlükleri, dikkat ve soyutlama-planlamada bozulmalar saptanır. Praksis muayenesinde beden-parçası-nesne-gibi cevaplar alınır. Henüz gnostik bir kusur saptanmaz. Somatik nörolojik muayene normaldir. MMSE skoru kabaca 20-26 arasında olabilir. Sıklıkla GDS 4, CDR 1 olarak evrelenirler. Bu hastaların otopsilerinde heteromodal kortekste NFYler, limbik sistemde nöritik SPler saptanır.
Orta demans evresine ulaşıldığında, hasta ev dışındaki bağımsızlığını artık tümüyle yitirmiştir. Gözetimle sokağa çıkabilse de, yalnız kaldığı takdirde yolunu bulamaz. Başkalarının evinde odaları karıştırabilir. Yeni öğrenme artık hemen hiç mümkün olamamaktadır. Anlama, okuma ve yazma giderek bozulur; evrenin sonlarına doğru imzası tanınmaz olabilir. Birinci derece yakınları hakkındaki bilgiyi genellikle korusa da, torunlarının sayısı, isimleri, okulları gibi bilgileri karıştırmaktadır. Evdeki işlevselliği son derece yüzeyselleşmiştir. Ancak sofrayı toplamaya veya sebze doğramaya yardım düzeyinde olabilir. Giyinme sırasında mevsime ya da günün saatine uygun giysiyi seçmede zorlanma, giysilerin sırasını karıştırma (gömleğin üzerine iç çamaşırı gibi), düğmeleri yanlış ilikleme gibi güçlükler başlar. Sofrada öncelikle bıçağı kullanamaz olduğunda yemeklerinin önceden kesilmesi gerekir. Giderek döküp saçarak yemek belirginleşir. Çatal-bıçağı karıştırmak, sıvıları çatalla almaya çalışmak gibi hatalar görülebilir. Yıkanmakta öncelikle sıcağı soğuğu ayarlamakla başlayan yardım gereksinimi ortaya çıkar. Henüz sfinkter kontrolü seyrek gece kaçırmaları dışında sorunsuzdur. Tuvalet mekaniği, elini yüzünü yıkamak gibi işlevleri kendi başına yapabilir. Davranışsal belirtiler artık vurgulanmaya başlamıştır. Hırsızlık, terkedilme ve sadakatsizlik hezeyanları olabilir. Yalnız kalmaktan ürker ve yakınını (eşi, çocuğu) sürekli gözünün önünde ister. Hekim vizitleri gibi yaklaşan randevular aşikar bir beklenti anksiyetesine yol açabilir. Uyku-uyanıklık ritminde bozulma artık belirginleşmiştir. Gece sık uyanmalar ve gündüz sık uyuklamalarla geçer. Muayenede hafif evre bulguları biraz daha ağırlaşmıştır. Dilsel işlevlere ait bulguların ağırlaşması dile dayanan testlerin yapılamaz olmasına neden olabilir. Praksis bozukluğu taraf apraksisi düzeyine ulaşabilir. Gnostik bozukluklar, özellikle sofrada göz önündeki nesneyi diğerleri arasından ayırıp bulamamak (simultanagnozi) şeklinde olabilir. Temel nörolojik muayenede hafif parkinsonyen değişiklikler saptanabilir. MMSE skoru 10-19 arasında değişir. GDS 5, CDR 2 olarak evrelenirler. Bu hastaların otopsilerinde NFYler heteromodal alanları tümüyle istila etmiş ve unimodal asosiasyon kortekslerine de yayılmış olabilir.
Ağır demans evresinde bellekte artık sadece parçacıklar söz konusudur. Yakınını (eşi, çocuğu) ana-babasıyla karıştırabilir, aynadaki kendi yüzünü tanıyamayabilir. Giyinmek, yıkanmak, yemek gibi temel GYAlarda artık tam bir gözetim gerekmektedir. Evrenin sonlarında yutma güçlüğü de ortaya çıkar. Kelime hazinesi son derece fakirleşmiştir. Evrenin sonlarında tüm verbal yetenekler yitirilir. Ambulasyon giderek zorlaşır ve sonlara doğru giderek oturmak dahi mümkün olmaz hale gelir. Televizyondaki kişileri ev içindeymiş gibi sanıp konuşmak, aynadaki kendi hayaliyle yabancıymış gibi konuşmak gözlenebilir. Ambulasyonun korunduğu sırada amaçsız dolaşma, istifçilik, amaçsız tekrarlayıcı hareketler izlenebilir. Tuvalet mekaniğinde bozulmalar (idrar ya da gaita sonrası uygun biçimde temizlenme, sifonu çekme sorunları), idrar kaçırma giderek belirginleşir. Epileptik nöbetler ortaya çıkabilir. Ağır evredeki hastaların formel muayenesi son derece güçtür ve mümkün olamayabilir. Muayenede global bir yıkım saptanır. Temel nörolojik muayenede tonus değişiklikleri, yürüyüş bozuklukları şeklinde parkinsonyen bulgular biraz daha ortaya çıkmıştır. MMSE 0-9 arasındadır. GDS 6-7, CDR 3 olarak evrelenirler. Şekil 2de AHnin klinik ve bir dizi laboratuvar ölçütünün pre-klinik evreden başlayarak ağır demans evresine kadar gösterdiği değişkenlik gösterilmektedir.
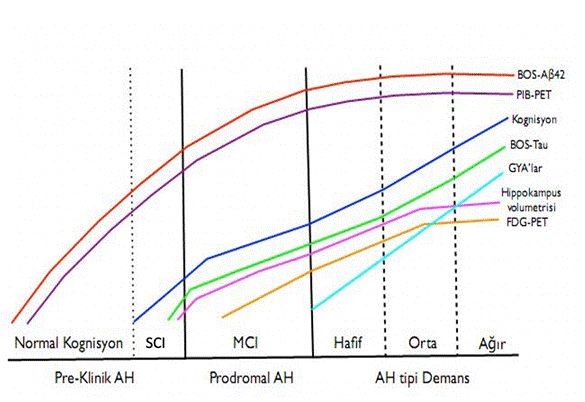
Şekil 2. Alzheimer hastalığının evreleri boyunca klinik ve laboratuvar göstergelerinin değişimi. BOS Aβ düzeyi daha preklinik evrede PIB-PET ile amiloid yükünün saptanabilmesinden önce düşmeye başlar; klinik evrelerden itibaren PIB-PET ile amiloid yükü fazlaca değişmez. SCIdan itibaren kognisyon bozulmaya, BOS tau düzeyleri artmaya başlar. MCI evresinde FDG-PET ile bölgesel metabolizma azalması izlenir olur ve sonrasında demans evreleri boyunca yaygınlaşarak şiddetlenir. Hippokampus hacmi MCIdan itibaren küçülmeye başlar. İşlevsel bozukluk (GYAlar) tanı gereği demans aşamasından itibaren başlar ve ilerleyici olarak kötüleşir.
BOS: beyin-omurilik sıvısı; FDG-PET: florodeoksiglikoz pozitron emisyon tomografisi; GYAlar: günlük yaşam aktiviteleri; MCI: hafif kognitif bozukluk; PIB: Pittsburgh bileşeni; SCI: sübjektif kognitif bozukluk
ALZHEIMER HASTALIĞI TANISINDA LABORATUVAR
Yukarıda da bahsedildiği üzere güncel olarak kullandığımız 2011 NIA-AA AH tanı kriterleri tanıya laboratuarı da dahil etmiş ve biyoişaretleyici (Bİ) olarak adlandırdığı çeşitli laboratuar yöntemlerini kullanarak hastalığın daha pre-klinik evrede tanınmasına olanak vermiştir. Bİler biyokimyasal Bİler ve nörogörüntüleme Bİleri olarak sınıflanabilir. Yerleşmiş biyokimyasal Bİler şimdilik sadece BOS Bİleri olsa da başta kan ve plazma olmak üzere (diğerleri, oral, oküler ve nasal sıvılar olarak sıralanabilir) erişimi daha kolay olan vücut sıvıları da aday Bİler açısından yoğun bir şekilde çalışılmaktadır. Nörogörüntüleme Bİleri MRG ile yapısal görüntüleme ve PET ile metabolik görüntüleme olarak sıralanabilir. Fonksiyonel MRG yöntemlerini de aday nörogörüntüleme Bİleri olarak sayabiliriz.
Yukarda Tanı Kriterleri kısmında değinildiği gibi, 2011 NIA-AA tanı kriterlerinde Bİler 2 gruba ayrılmıştır: (1) Aβ birikimine işaret edenler ve (2) nörodejenerasyona işaret edenler. Birinci grupta amiloid PET görüntülemede anormal tutulum ve BOSta düşük Aβ42 düzeyleri yer alırken, ikinci grupta artmış BOS total ve fosforile tau düzeyleri, FDG-PETte spesifik topografik tutulum gösteren azalmış fluorodeoxyglukoz tutulumu (hipometabolizma), yapısal MR görüntülemede spesifik topografide atrofi yer almaktadır. 2018 yılı NIA-AA tanı kriterlerinde ise Bİler 3 gruba ayrılmıştır. AT(N) sınıflaması olarak da bilinen bu sistemde amiloid birikimi belirteçleri (A), fosfo-tau (p-T) birikimi belirteçleri (T) ve nörodejenerasyon belirteçleri (N) olarak ifade edilmiştir. BOSta Aβ42 düzeyinin eşik değerin altına düşmesi ya da amiloid PET ile amiloid birikiminin gösterilmesi A pozitifliği, BOSta p-T düzeyinin eşik düzeyin üzerine çıkması ya da Tau PET ile tau birikimin gösterilmesi T pozitifliği, yapısal MRGde atrofi ya da FDG-PETte hipometabolizma ya da BOSta total tau (t-T) düzeyinin eşik düzeyin üzerine çıkması (N) pozitifliği anlamına gelmektedir.
Beyin Omurilik Sıvısı Biyoişaretleyicileri
BOS Bİleri pratik olarak Aβ42, t-T ve p-T düzeylerine karşılık gelir. 1990lı yıllardan itibaren üzerinde çalışılmaya başlanmıştır. AHde BOS Aβ42 düzeyi düşerken, t-tau ve p-tau düzeyleri yükselmektedir. Alzheimer hastalarında kontrol grubuna göre BOS Aβ42 düzeyinin yaklaşık %50 oranında azaldığı, t-T ve p-T düzeylerinin ise %300 oranında arttığı çeşitli çalışmalarda gösterilmiştir. Semptomatik AH hastalarında BOSta Aβ42 düzeyinde azalmayla beraber t-tau ve p-tau düzeylerinde artış hastalık tanısında %80 düzeylerinde bir sensitivite ve spesifiteye sahiptir. Biz Cerrahpaşa Tıp Fakültesi, Tıbbi Biyoloji Anabilim Dalı, Beyin ve Nörodejeneratif Hastalıklar Araştırma Laboratuvarında analiz ettiğimiz BOSlarda eşik değerler olarak Aβ42<813pg/ml, p-T>52pg/ml, t-T>375pg/ml kullanıyoruz (bkz. Kutu 1).
|
Kutu 1. İstanbul Üniversitesi Pratiğinde BOS biyoişaretleyicileri
İstanbul Üniversitesi-Cerrahpaşa, Cerrahpaşa Tıp Fakültesi, Tıbbi Biyoloji Anabilim Dalı, Beyin ve Nörodejeneratif Hastalıklar Araştırma Laboratuarlarında BOSta Aβ1-42, p-tau181 ve t-tau testleri ücretli olarak yapılmaktadır.
Alından BOS örneğinin LP yapıldıktan 2 saat içerisinde laboratuvara ulaştırılması gerekmektedir. 2 saati aşacak durumlarda buz aküleriyle transfer edilmelidir. Şehir dışından örnek gönderilebilir fakat özellikle 1 günü aşacak sürelerde kuru buz içerisinde transfer yapılması sağlanmalıdır.
Aβ1-42, p-tau181 ve t-tau sonuçlarına ek olarak çeşitli çalışmalar tarafından önerilmiş olan Mulder, hulstaert ve t-tau/Aβ 1-42 oranı sonuçları da verilmektedir. Sonuç sayfasında değerlendirme için uygun kesme değerleri de belirtilmektedir.
Doğru değerlendirme için LP atravmatik olmalı, BOS hacmi en az 4 ml olmalıdır. Örnekler polisistren tüplere değil polipropilen tüplere alınmalıdır. Polisistren tüplerde Aβ bağlanması yüksek olduğu için sonucu etkileyebilmektedir.
Örneğin uygun şekilde alınması, laboratuara uygun şekilde ulaştırılması ve sonuçların doğru değerlendirilebilmesi açısından klinisyen ve laboratuarın işlem öncesinden başlanarak iletişim halinde olmaları oldukça önem kazanmaktadır. |
AHde beyin parenkiminde birikmesi nedeniyle BOS Aβ42 düzeyi düşmektedir. Amiloid PET görüntülemeyle saptanan serebral amiloid yüküyle yüksek negatif korelasyona sahiptir. Amiloid pozitifliği AT(N) terminolojisinde, klinik belirtilerin mevcut olup olmamasından bağımsız bir şekilde Alzheimer sürekliliğini başlatır. AH-P süresince BOS düzeyi progresif olarak azalır, erken AH-K evrelerinden itibaren plato çizmeye başlar. BOS Aβ42 AHyi kontrol grubundan ve diğer nörodejeneratif hastalıklarından ayırmada yüksek doğruluğa sahip bir Bİdir.
BOS Aβ42 düzeyi kullanımında kişiler arası farklılıklar nedeniyle kısıtlılıklar ortaya çıkmaktadır. Bu sorun Aβ42/Aβ40 oranı hesaplanarak Aβ42nin normalizasyonu yoluyla kısmen çözülebilmiştir. Aβ40 AHde değişmemektedir bu nedenle toplam Aβ düzeyini yansıtan bir gösterge gibi kullanılmaktadır. Aβ38 düzeyi de AH ve kontroller arasında değişmediğinden BOS Aβ42/Aβ38 oranı da kullanılabilmektedir.
Bu işaretleyicilerin kan, plazma ve diğer vücut sıvılarında ölçülebilmesine yönelik çeşitli çalışmalar sürse de metodolojik farklılıklar nedeniyle henüz tutarlı sonuçlar elde edilememiştir.
AHde BOS t-T ve p-T düzeyleri yükselmektedir. p-T serebral NFY/NT yükünü temsil eder ve tau PETde saptanan tau yükü ile yüksek pozitif korelasyona sahiptir. AT(N) terminolojisinde, Alzheimer sürekliliğinde olan bir bireyde p-T pozitifliği klinik belirtilerin mevcut olup olmamasından bağımsız bir şekilde Alzheimer hastalığı tanısı koydurur. En iyi araştırılmış p-T epitopu threonine 181 (p-tau181)dir. Ancak p-tau231 ve p-tau199 da p-tau181 ile yüksek derecede koreledir. Her üçü de benzer tanısal doğruluğa sahiptir. Yukarda da değinildiği gibi A-T+ durumlar amiloidozsuz taupatileri, özellikle de ileri yaştaki hastalarda PART ve AGD gibi izole taupatileri düşündürmelidir. t-T nöronal hasar sonucu salındığı için BOS t-T artışı nöron kaybının derecesini ve nörodejenerasyonu yansıtan non-spesifik bir bulgudur. AH dışında LCD, FTD ya da prion hastalıkları gibi birçok nörodejeneratif hastalıkta artmış BOS t-T düzeyleri gösterilmiştir. Travmatik beyin hasarı, inme ve otoimmün ansefalitlerde BOS t-T düzeyinde nöronal hasarın derecesiyle korele olarak geçici ama belirgin bir artış görülebilir fakat p-T düzeyi normaldir. Creutzfeldt-Jakob hastalığında hızlı bir nörodejenerasyon mevcuttur fakat PHF tau birikimi görülmez. BOS t-T düzeyi AHye oranla 10-20 kat daha fazla artarken, p-T düzeyi normaldir ya da minör değişiklik gösterir. BOS t-T ve p-T düzeyleri AHde kognitif bozulmayla Aβye oranla çok daha güçlü bir korelasyona sahiptir, Alzheimer sürekliliğinde sıklıkla AH-Knın başlangıcını işaret eder ve AH-K boyunca düzeyleri artmaya devam eder.
Amiloid gibi tau proteininin de diğer vücut sıvılarında ölçülebilmesine yönelik çalışmalar sürmektedir.
Mielke ve arkadaşları 2018 yılında plazma P-tau181in iyi bir AH biyoişaretleyicisi olabileceğini gösterdiler. Plazma P-tau181 düzeyi amiloid ve tau PET ile korele bulunmuştur. Erken dönemde Aβ ilişkili tau patolojisine işaret ettiği, hem tanısal açıdan hem de hastalık evresini belirlemek amacıyla yararlı olabileceği gösterilmiştir.
Yakın zamanda ise Palmqvist ve arkadaşları tarafından 3 büyük AH kohortunda yapılan çalışmada plazma P-tau217 düzeyinin klinik olarak tanı konulmuş AH demansını diğer nörodejeneratif hastalıklardan, ayrıca nöropatolojik olarak AH tanısı almış bireyleri nöropatolojik olarak AH kriterlerini doldurmayan bireylerden yüksek doğrulukta ayırabildiği gösterilmiştir. Ayrıca plasma P-tau217nin AH tanısında plazma P-tau181, plazma nörofilament hafif zincir ve MRG ölçümlerine kıyasla anlamlı düzeyde yüksek tanısal keskinliğe sahip olduğu, BOS P-tau217, BOS P-tau181 ve tau-PET ölçümleriyle ise anlamlı bir farklılık göstermediği bildirilmiştir. Bu heyecan verici bir gelişme olmakla birlikte testin yaygın kullanıma girebilmesi için daha fazla çalışmaya ve ölçümlerin optimizasyonuna ihtiyaç vardır.
Alzheimer hastalığında üzerinde çalışılmakta olan diğer Bİler için Milà-Alomà ve ark., 2019 ile Zou ve ark., 2020 referansları incelenebilir.
Nöro-Görüntüleme Biyoişaretleyicileri
Görüntüleme yöntemleri vücut sıvısı biyoişaretleyicilerinden farklı olarak hastalığın farklı dönemlerini zamansal, anatomik ve işlevsel olarak gösterme imkanı sunmaktadır.
Yapısal Manyetik Rezonans Görüntüleme
Alzheimer hastalığında yapısal manyetik rezonans görüntüleme daha önceden sadece ayırıcı tanı amacıyla kullanılırken, hastalığa özgü atrofi örüntüsünün tanımlanmasıyla doğrudan hastalığın tanısında kullanılabilir olmaya başladı.
Tipik amnestik AHde yapısal MRGde mediyal, bazal ve lateral temporal loblarda ve mediyal pariyetal kortekste atrofi görülmektedir.
Hippokampus hacmi ve bunun zaman içerisindeki değişimi koronal, T1-ağırlıklı görüntülerle değerlendirilebilmektedir. Sağlıklı yaşlanma, MCI ve AHD gruplarıyla yapılan çalışmalar her üç grupta da zamanla hippokampal hacim kaybı olduğunu fakat AH ve MCI gruplarında bu azalmanın daha hızlı gerçekleştiği, sağlıklı yaşlanma olarak tarif edilen kontrol grubunda ise bu azalmanın daha düşük bir hızda gerçekleştiği gösterilmiştir. AHde saptanan hippokampal atrofi kognitif bozulmayla koreledir. Klinik pratikte hippokampal atrofi görsel derecelendirmeyle değerlendirilebilir. Scheltens ve arkadaşları tarafından önerilen mediyal temporal lob atrofisi (MTA) görsel skorlamasında koronal, T1 ağırlıklı görüntülerde hippokampal atrofi 1-4 arası derecelendirilmektedir.
FreeSurfer yazılımıyla kortikal kalınlık ve voksel temelli morfometri (VBM) yöntemleri nörodejeneratif hastalıklarda kortikal atrofi ve doku-hacim kaybının nesnel nicel ölçütlerini sağlarlar. Kortikal kalınlık ile entorhinal kortekste (ECx) incelme, VBM ile ilk yöntemle saptanılamayacak olan hippokampal atrofi bulguları hassas bir şekilde gösterilebilir. Yüksek rezolüsyonlu yapısal MRG çalışmaları (7T) ve mediyal temporal lobun alt segmentasyonuyla hangi yapıların hastalık patogenezinden daha fazla etkilendiğine dair bilgiler edinilebilir olmuştur. Böylelikle MCIda CA1 ve CA3/dentat girus bölgelerinde hacim kaybı olduğu gösterilmiştir. ADde ise subikulum, CA1 ve ECxte hacim kaybı bildirilmiştir. Sonraki çalışmalarda özellikle ECxte hacim kaybının hippokampal atrofiyi öngördüğü, amiloid ve tau birikimi delilleri taşıyan asemptomatik bireylerde ECx kalınlığında azalma olduğu, ECx hacim kaybının MCIdan AHye dönüşümü öngördüğüne dair sonuçlar elde edilmiştir. Tersine CA3 hacminin AH-K boyunca uzun süre kayda değer bir değişiklik göstermediği saptanmıştır. Kortikal kalınlık ve/veya VBM tipik amnestik sunum ile atipik sunumlar arasındaki örtüşen ve ayrışan serebral alanları da gösterebilir. Örneğin, tipik amnestik sunum ile atipik görsel sunumu (PKA) karşılaştıran bir kombine kortikal kalınlık ve VBM çalışmasında MTLde kalınlık azalması ve hacim kaybının tipik AH, superiyor pariyetal lobüldeki kalınlık azalması ve volüm kaybının PKAya özgü olduğunu, buna karşılık her iki grubun precuneustaki incelme ve kayıpta örtüştükleri gösterilmiştir.
Rutin klinik pratikte bu yöntemler mümkün olmasa da kognitif yakınmayla değerlendirilen bireyde yapısal MRGde MTA görsel değerlendirme skorlamasıyla hippokampal hacim kaybı olup olmadığının değerlendirilmesi ve uzunlamasına takiplerinde azalma olup olmadığının izlenmesiyle klinik gidişat hakkında fikir edinmek mümkün olmaktadır.
Difüzyon tensor görüntüleme (DTI) beyaz madde yolaklarına spesifik bir yapısal görüntüleme tekniğidir ve dolayısıyla geniş boyutlu nöral ağlarda yapısal bağlantısallığın prototipik görüntüleme yöntemidir. Beyaz maddede su molekülleri aksonal lifler boyunca nüfuz etme (diffuse) eğilimindedir. Difüzivitenin bu yönelimsel bağımlılığına anizotropi denir. DTI, en özet olarak, anisotropik difüzyon aracılığıyla serebral aksonal bağlantısallığı hesaplayıp maksimum aksonal difüziviteyi görüntü olarak yansıtmaya dayanan tekniktir denilebilir. Temel DTI metriği olan fraksiyonel anizotropi (FA), difüzyon ile moleküler deplasmanın yönelimini gösterir ve FA azalması bağlantısallıktaki azalmaya karşılık gelir. Traktografi DTI verilerinin 3 boyutlu rekonstrüksiyonu ile elde edilen serebral yolakların yüksek rezolüsyonlu görüntülemesidir. DTI özellikle çaprazlaşan liflerde rezolüsyon sorunu yaşar. Zaman içinde geliştirilen bir dizi yeni teknik (örn., DSI, GQI) özellikle bu soruna odaklanarak sorunun düzeyini azaltmış, ancak bunun karşılığında çok daha uzun zaman tüketimini gerektirmiştir. HARDI hem çaprazlaşan liflerde DTIya üstün hem de yukarda anılan diğer iki teknik kadar zaman gerektirmeyen en yeni tekniklerdendir. AHde DTI çalışmaları, özellikle erken dönemlerde Papez devresini birbirine bağlayan limbik ve paralimbik yolaklara odaklanmıştır. Bunlar arasında forniks ve ventral cingulumdaki FA azalmaları özellikle ön plana çıkmaktadır. Bir çalışmada forniks FA azalması kesitsel olarak hippokampus hacmiyle korele, uzunlamasına izlemde ise kognitif bozulma ile korele bulunmuştur. Son derece ilgi çekici bir şekilde bir başka çalışmada forniksteki belli bir FA eşiği altına düşme (FA<0.52 voksel) forniks işareti (FS) olarak tanımlandı ve uzunlamasına izlemde FS+ olan kognitif olarak normal bireylerin aMCI, aMCI bireylerin ise AHDye ilerlemesini %94-100 arasında değişen çok yüksek özgüllükte, fakat daha mütevazi duyarlılıkta (%67-83) öngördüğü gösterildi.
Son yıllarda yapısal MRGde nöromelanine duyarlı yöntemlerin geliştirilmesi substantia nigra pars compacta (SNpc) ve locus coeruleus (LC) gibi nöromelaninden zengin beyin sapı çekirdeklerinin daha hassas biçimde görüntülenebilmesini sağlamıştır. SNpcde dejenerasyon ve nöron kaybının Parkinson hastalığında motor bulguların ağırlığıyla korele etmesi gibi, LCde nöron kaybı AHde kognitif bulguların ağırlığı ve uzunlamasına izlemlerde kognitif kayıpla korele eder. Bu nedenle LCde nöronal kaybın derecesini yansıtabilen bir görüntüleme tekniği çekici bir nörogörüntüleme Bİsi olabilir. Bu amaçla yapılan görüntüleme çalışmalarına LC-görüntülemesi veya LC-integritesi (LC-I) adı verilmiştir. Bir dizi yeni modifikasyonlar önerilse de klasik yöntem 2D T1-ağırlıklı turbo spin eko (TSE) ile LCnin nöromelanin kökenli yüksek sinyalini görüntülemektir. AH sürekliliğinde LC-I çalışmaları tam bir uzlaşım içinde olmasa da LC kontrast azalmasının AHD ve MCI gruplarını birlikte sağlıklı kontrollerden ayırdığı, sadece AHDyi ayırıp MCIyı ayıramadığı şeklinde sonuçlar bildirilmiştir. Bir çalışmada LC kontrast azalmasının BOS Aβ42 azalmasıyla korele ettiği bulunmuştur.
Pozitron Emisyon Tomografisi
[18F]FDG-PET
[18F]-2-Fluoro-2-deoxy-D-glucose (FDG) yapay bir glikoz analoğudur ve dokunun glikoz metabolizması hakkında bize fikir vermektedir. Nörolojide özellikle nörodejeneratif hastalıkların tanısında kullanılmaktadır. Bölgesel olarak azalmış FDG tutulumu sinaptik ve nöronal hasarı yansıtmaktadır.
AHde gözle görülür atrofi ortaya çıkmadan önce precuneus, mediyal temporal korteksler ve temporo-parietal simetrik bir hipometabolizma görülebilir. MCIdan AHDye dönüşümü %76 sensitivite ve %82 spesiviteyle öngördüğü bildirilmiştir. Atipik bir AH formu olan posterior kortikal atrofide oksipital, logopenik varyant PPAda sol parietal hipometabolizma görülür. AHnin tipik ve atipik formalarını birbirinden ayırabildiği gibi diğer nörodejeneratif hastalıklardan da ayırmada kullanılır.
FDG-PETteki bölgesel hipometabolizma AT(N) sınıflamasında (N) kategorisine alınmıştır ve nörodejenerasyon belirteci olarak yorumlanmaktadır.
Amiloid-β PET
Karbon (C-11) işaretli Pittsburgh bileşeni B (PiB), ilk kullanılan amiloid ligandıdır ve APlere yüksek afiniteye sahiptir. Fakat karbon işaretli ligandların yarı ömrünün çok kısa olması (20 dk) kullanımını oldukça sınırlandırmaktadır. Bu nedenle daha sonra daha uzun ömürlü olan (yaklaşık 110 dk) flor (F-18) işaretli [18F]flutemetamol, [18F]florbetapir ve [18F]florbetaben gibi bileşenler kullanılmaya başlanmıştır. Amiloid PET ile saptanan serebral amiloid yükü ile otopside nöropatolojik olarak saptanan amiloidozun çok yüksek bir uyum gösterdikleri bulunmuştur.
AH tanısı almış kişilerde yapılan amiloid-PET çalışmalarında neredeyse tüm hastalarda amiloid birikimi gösterilmiştir. Bu yüksek tekabül özellikle amiloid görüntülemede kullanılan PiB ile fibriler Aβ arasındadır. Bu bileşen fibriler Aβya bağlanırken, çözünebilir Aβ ya da difüz plaklara bağlanmamaktadır. Çözünebilir formlar daha önce değinildiği gibi sinaptik disfonksiyona neden olan formlardır. Dolayısıyla, amiloid PET görüntülemesi negatif bireylerde dahi nöral ağların fonksiyonel görüntülemesinde özellikle APOE-ε4 taşıyıcıları gibi riskli bireylerde bağlantısallık azalması saptanabilir.
Amiloid birikiminin en erken görüldüğü bölgeler posterior singulat korteks ve retrosplenial korteksi de içine alan precuneustur. Bu mediyal parietal bölgeler tau birikiminin en erken başladığı MTL yapılarıyla ventral cingulum aracılığıyla karşılıklı bağlantılıdır.
Amiloid birikimi kognitif bozulmayla ne yükün şiddeti ne de topografisi açılarından korele eder. Bununla birlikte, tipik ve atipik olgularda aynı birikim topografisi klinik sunumdan bağımsız olarak AH tanısı koydurur. Diğer yandan, pre-klinik evrenin bir işaretidir. Çalışmalar kognitif olarak normal olarak katılan bireyler arasında gerçekten sağlıklı kontrolleri ve pre-klinik AHli bireyleri birbirinden ayırır. Dolayısıyla, asemptomatik iken gerçek anlamda koruyucu AH-aşısı klinik çalışmalarına katılımının sağlanabilmesi açısından önemli katkı sağlamaktadır.
Tau PET
Tau PET görüntüleme, ancak otopside saptanabilen tau yayılımın in vivo olarak gösterilmesine olanak sağlamıştır. Böylelikle, geçen yüzyılda klinisyenlerin elinden alınıp, nöropatologlara teslim edilmiş gibi görünen AHnin kesin tanısı itibarı henüz yaşamakta olan hastada da klinisyenler tarafından da konulabilir hale gelmiştir. Tau-PET ligandları taunun PHF formuna afinite göstermektedirler ve 3R/4R izoformunu tanımaktadırlar. Bu izoform diğer taupatilerde de görülebileceğinden hastalıklar arası ayırım yapabilmek için ligandın patolojiye spesifik anatomik dağılımına göre yorum yapılması gerekmektedir.
İlk jenerasyon ligandlar 11C]PBB3, [18F]THK523, [18F]THK5105, [18F]THK5351 ve [18F]flortaucipir iken, daha sonra hedef-dışı bağlanmaları daha düşük olan ikinci jenerasyon ligandlar [18F]RO948, [18F]GTP1, [18F]PI2620, [18F]PM-PBB3 ve [18F]MK6240 üretilmiştir.
Tau-PET ile saptanan patolojik tau birikiminin hem kognitif bozulma şiddeti hem de topografisi ile korelasyonun yüksek olduğu gösterilmiştir. Topografik farklılıklar tipik ve atipik klinik sunumları birbirlerinden net bir şekilde ayırt eder.
AT(N) sınıflamasında PET ile tau birikiminin gösterilmesi T pozitifliği anlamına gelmektedir.
Fonksiyonel Manyetik Rezonans Görüntüleme
Fonksiyonel MRG (fMRG) kan oksijenlenme seviyesine bağlı (blood oxygen level dependent-BOLD-) sinyalleri ölçen bir görüntüleme yöntemidir. BOLD sinyali nöral aktivitenin dolaylı bir yansımasıdır. BOLD sinyalleri görev bağımsız biçimde entrensek yavaş salınımlar göstermektedirler. İstirahat durumu fMRG (rs-fMRG) birden fazla anatomik bölgeye ait yavaş BOLD salınımlarının zamansal korelasyonunun bu bölgelerin birbirleriyle fonksiyonel olarak etkileştiği varsayımından yola çıkmaktadır. Böylece beyinde dinlenim durumu ağları olarak tanımlanan geniş boyutlu, görev-bağımsız ağlar tanımlanmıştır. Nörodejeneratif hastalıklarda bu ağların bağlantısallığının nasıl etkilendiği üzerine giderek artan sayıda çalışma yürütülmektedir.
Bu ağlardan AH için en çok dikkat çekeni, yukarda değinildiği gibi, olağan durum ağı (default mode network-DMN) olmuştur. DMN görüntüleme esnasında katılımcıya bir görev verildiğinde aktivitesini istirahat durumuna göre azaltan bir kognitif şebekedir. Ödevden bağımsız, istirahat halinde iken en aktif durumdadır.
Yaklaşık 20 yıldır nörodejeneratif hastalıklarda çalışılmakta olan rs-fMRG veya ICN görüntülemesi çalışmaları, özellikle AHde daha en erken evrelerden başlayan DMNdeki progresif bağlantısallık azalmasını ortaya koymuştur. Son yıllarda, farklı nörodejenerasyonları tek tek ICN yatkınlıklarıyla anlamaktan çok, bunların neden olduğu gerek tek tek ağ-içi değişiklikler, ama aynı zamanda ağlar-arasındaki etkileşim değişiklikleri üzerinde durulmaktadır.
Bununla birlikte, bulunan farklılıklar grup karşılaştırmalarındaki istatistik anlamlılıklardır ve tek tek bireylerde tutarlı bir biçimde gösterilmeleri henüz mümkün olmamıştır. Bu yüzden bu görüntüleme teknikleri henüz bir nörogörüntüleme Bİsi olarak değerlendirilemez.
EPİDEMİYOLOJİ
Prevalans ve İnsidans
Dünyada şimdiye kadar yapılan prevalans (belli bir zaman kesitinde bulunan tüm olguların nüfusa oranı) çalışmalarının metaanalizi 65-70 yaşları arasında %4-5 kadar olan AHnin her 5 yılda bir katlanarak artıp 90lı yaşlarda %50ye kadar ulaştığını ortaya koymaktadır.
Türkiyeden ilk çalışma diyebileceğimiz Istanbul, Kadıköyde gerçekleştirilen Türkiye Alzheimer Prevalans Çalışması (TAPS) sonuçları Tablo 3te gösterilmiştir. Doksanlı yaşlardan sonra artışın devam etmeyip bu oranın plato çizdiği (AH yaşla ilintilidir) görüşü ile sürekli yükseldiği (AH yaşlanmayla ilintilidir) görüşü arasındaki geçen yüzyıldaki tartışma ilki lehine çözümlenmiş gibi durmaktadır. Bu ileri yaşlarda, PART, AGD ve LATE gibi yeni nörodejenerasyon tipleri belirmekte ve yaşla birlikte giderek artmaktadır.
Tablo 3. TAPS Çalışmasında yaşa ve cinsiyete göre katmanlandırılmış prevelans oranları (Gürvit, 2008)
|
|
PRAD |
Toplam AH |
Toplam Demans |
|
Yaş grupları bir arada Tümü Erkek Kadın |
%11 %9 %13 |
%16 %13 %17 |
%20 %17 %22 |
|
Cinsiyet grupları bir arada 70-74 75-79 80+ |
%9 %14 %13 |
%14 %19 %17 |
%18 %22 %23 |
|
Erkek 70-74 75-79 80+ |
%8 %9 %11 |
%12 %12 %16 |
%16 %15 %20 |
|
Kadın 70-74 75-79 80+ |
%10 %18 %15 |
%15 %23 %20 |
%19 %26 %25 |
PRAD: muhtemel Alzheimer hastalığı; toplam AH: PRAD artı mümkün AH; toplam demans: toplam AH artı non-AH demanslar.
2019 yılı verilerine göre dünya çapında demans tanısı almış 50 milyon kişi yaşamaktadır. Bu sayının 2030 yılında 82 milyon, 2050 yılında ise 152 milyon kişiye ulaşacağı varsayılmaktadır. Alzheimer hastalığı (AH) ise tüm demans tipleri arasında %60-80 görülme sıklığına sahiptir.
Yaşa-özgül insidans, ya da belli bir zaman aralığında ortaya çıkan yeni olguların sayısı da yaş aralıkları arttıkça hızla artar. 1998 tarihli bir meta-analizlerinde 65-69 ile başlayıp 85-89 ile sonlanan 5er yıllık 5 yaş katmanında insidans %1.6, %3.5, %7.8, %14.8 ve %26.0 şeklinde yine katlanarak artmaktadır.
Risk Faktörleri ve Koruyucu Faktörler
Birçok hastalıkta olduğu gibi AHde de risk faktörleri değiştirilebilir ve değiştirilemeyen risk faktörleri olarak ikiye ayrılmaktadır. AH için değiştirilemeyen risk faktörleri yaş, genetik ve cinsiyettir. Değiştirilebilir risk faktörlerine ise tedavi edilebilir tıbbi durumlar ve yaşam tarzı dahildir.
Günümüzde yaşam beklentisindeki dramatik artış global bir fenomendir ve yaşlı nüfusun artması ile AH daha fazla bir toplumsal sorun olmaktadır. Hastalığın toplumsal maliyetinin demans şiddetiyle doğru orantılı olduğunu gösteren çalışmalar mevcuttur.
Bir risk faktörü olarak cinsiyet tartışmalıdır. Birçok çalışma AH prevalansının kadınlarda erkeklere göre daha fazla olduğunu göstermektedir. Ancak bu prevalans farklılığı genellikle kadınlarda yaşam beklentisinin daha uzun olmasıyla açıklanmaktadır. Bununla birlikte östrojen beyinde bir nörotrofik faktör olarak işlev görmekte, erkeklerde ömür boyu mevcut olan testosteron beyinde östrojene çevrilip işlevini sürdürürken, kadınlar menopoz sonrası östrojensiz kalmaktadırlar. Bu durum yaşamın ikinci yarısında bir nörotrofik faktörden yoksun kalan kadınların neden demans için daha fazla risk taşıdıklarının açıklamalarından biri olabilir. Nitekim, epidemiyolojik çalışmalarda post-menopozal dönemde östrojen replasmanı kullanan kadınlarda kullanmayanlara göre demans prevalansının daha düşük olması bu varsayımı destekler niteliktedir ama jinekolojik kanser riski artışı nedeni ile bu yöntem koruyucu bir tedavi olarak kullanılamamaktadır.
Cinsiyetin gerçek anlamda bir risk olup olmadığına daha iyi bir cevap verebilecek olan insidans çalışmalarının sonuçları ise çelişkilidir. Bir çalışma 85 yaşının üzerindeki erkeklerde AH insidansını yılda %2,7, buna karşılık kadınlarda %8,9 olduğunu bulmuştur. Başka bir çalışmada ise bir AHlinin 1. derece kadın akrabalarının 1. derece erkek akrabalarına göre yaşam boyu hastalık riskinin daha fazla olduğu gösterilmiştir. Ancak çok sayıda başka çalışmacı grubu bu farklılığı doğrulamayarak herhangi bir farklılık bulmamışlardır. TAPS çalışmasında da kadınlarda prevalans daha yüksek olsa da cinsiyetin bir risk faktörü olmadığı görülmüştür. Bununla birlikte, dört ayrı prospektif Avrupa çalışmasının havuzlanmış verilerini analiz eden EURODEM Insidans Araştırma Grubu kadın cinsiyetin 85 yaş ile birlikte bir risk faktörü olarak belirdiğini, 90 yaş üzerinde bu riskin daha da arttığını bildirmişlerdir. TAPS çalışmasında 85 ve 90 yaş üzeri tabakalardaki birey sayısının azlığı bizim çalışmamızdaki negatif sonucun açıklaması olabilir.
Dominant geçişli ailesel AH olguları harici, ailede demans öyküsü AH için kendi başına bir risk faktörüdür. AHli hastaların kardeşlerinde yaşam boyu hastalık riski beklentisi ikiye katlanarak %23ten %48e çıkar. Monozigotik ikizlerde dizigot ikizlere oranla AH birlikteliği anlamlı oranda fazladır.
Down sendromu aile öyküsü olması AH riskini 2 ila 3 misli arttırmaktadır. Ayrıca Down sendromlu çocuk doğuran annelerin AH riski, diğer tiplerde mental retarde çocuklar doğuran annelere göre 5 misli fazla bulunmuştur.
APOE-ε4 aleli taşımak AH için risk iken ε2 aleli bazı çalışmalarda koruyucu gibi görünmektedir. ε2nin β-amiloid fragmanının temizlenmesinde etkin bir alternatifi temsil ettiği düşünülmektedir.
Diabetes mellitus, sigara, depresyon, mental inaktivite, fiziksel inaktivite, beslenme yetersizliği veya kötü beslenme, hipertansiyon, obezite ve düşük eğitim hem AH için hem de kognitif bozulma için değiştirilebilir risk faktörleri olarak bildirilmiştir.
Yorumu tartışmalı olsa da düşük eğitimin başlı başına bir risk faktörü olduğu artık yerleşmiş bir bilgidir. Eğitim deneyimindeki artışın ve mental aktivitenin bireyin kognitif rezervinin genişlemesine yol açarak hastalığın ortaya çıkış eşiğini yükseltmesi çekici bir açıklama gibi durmaktadır. Rezerv kavramı AH patolojik değişikliklerinin başlamasıyla AH kognitif bozulmasının başlaması arasında geçen süre ve otopside AH patolojik değişiklikleri saptandığı halde klinik olarak asemptomatik kalan bireyleri açıklama çabası nedeniyle ortaya çıkmıştır. Beyin rezervi beynin maruz kaldığı patolojik değişikliklere dayanma ve normal fonksiyonunu sürdürme kapasitesini ifade ederken, kognitif rezerv ise patolojinin ortaya çıkardığı etkilerle başa çıkabilmek için alternatif beyin ağları ya da kognitif stratejiler kullanabilme yeteneğini ifade etmektedir. TAPS çalışmasında da düşük eğitim demans için bir risk faktörü olarak belirlenmiştir.
Kardiyovasküler ve serebrovasküler risk faktörleri ve inme öyküsünün AH riskini anlamlı biçimde arttırdığı birçok çalışmada gösterilmiştir. Yüksek kan basıncının AH ve demans riski artışıyla ilişkili olduğu, AH patolojisini arttırdığı bildirilmiştir.
Yüksek kan basıncı kan beyin bariyeri bütünlüğünü bozarak beyin dokusuna enflamatuvar protein sızmasına ve bunun sonucu olarak da hücre hasarı, apoptoz ve Aβ birikiminin artışına yol açarak AH riskini arttırıyor olabilir. Ancak hipertansiyonun Aβ birikimine yanıt olarak serebral hipoperfüzyona karşı protektif bir mekanizmayla ortaya çıktığı da öne sürülmektedir. Bu da hipertansiyon ve AH arasındaki nedensel ilişkinin henüz tartışmaya açık olduğunu göstermektedir.
Diyabet artmış AH riskiyle ilişkilendirilmiştir (RR = 1.39). Hiperinsülineminin beyinde bir amiloid-beta peptidi şaperon molekülü olarak işlev gören insülin-degrade edici enzim (IDE) için yarışarak (MSSden insülin katabolizması için sistemik kullanıma çekilerek) beyinde Aβ klirensini bozduğu öne sürülmektedir. Bazı çalışmalar ise diyabetin doğrudan AH patolojisini arttırmadığı, bunu serebrovasküler riski arttırarak dolaylı olarak yaptığını öne sürmüştür.
Yüksek kolesterol düzeyleri artmış Aβ seviyesi, kognitif bozulma ve AH progresyonuyla ilişkilendirilmiştir. Buna paralel olarak, kolesterol düşürücü ajanları (statinler) kullananlarda AH prevalansın daha düşük olması yerleşmiş epidemiyolojik bilgilerdendir. Kolesterolün Aβ yıkımını azalttığı ve üretimini arttırdığı öne sürülmüştür.
İnme öyküsü yaşlı hastalarda AH riskini 2 kat arttırmaktadır. İnmeyle birlikte aterosklerotik risk faktörlerinin varlığında risk artar. İnme öyküsü daha kötü kognitif performansla ve klinik olarak daha ağır bir demansla ilişkilidir. Serebral hipoperfüzyonun hipoksiyle sonuçlandığı, hipoksinin ise BACE1 geninin transkripsiyon ve ekspresyonunu arttırarak Aβ üretimini arttırdığı gösterilmiştir. Aynı zamanda bir inme risk faktörü olan yüksek plazma homosistein düzeyinin AH için de bağımsız bir risk faktörü olduğu bildirilmiştir. Atrial fibrilasyon, aritmiler, kardiyak arrest gibi kalp hastalıkları beyin perfüzyonunu bozarak hücre hasarı dolayısıyla kognitif bozukluk ve Aβ üretim artışına yol açarak giderek demansa neden olabilirler.
Sigara içenlerde, kolinerjik nikotinik reseptörlerin yukarı-regülasyonu ve bunun sonucu olarak Aβ düzeylerinin düşmesi ile açıklanan biçimde AHnin daha az görüldüğü bulgusu, başlangıçta sigara içenlerin ileri yaşlara gelmeden diğer hastalıklar nedeniyle ölmeleri ve vasküler demansa daha yatkın olmaları şeklinde metodolojik olarak eleştirilmişken, Rotterdam ve New York çalışmalarında tam tersine AH riskini birkaç kez arttırdığı yönünde bulgular elde edilmiştir. Sigaranın AH için rölatif riski düşük olsa da (RR = 1.201.60), oksidatif gerilim ve enflamatuvar mekanizmalar üzerinden AH riskini arttırabileceği düşünülmektedir.
Çalışmalarda hem düşük hem de yüksek vücut ağırlığının kognitif bozulma ve AH riskinde artışla ilişkili olduğu gösterilmiştir. Özellikle orta yaşta obezitenin AH riskini %60a kadar arttırdığı gösterilmiştir. Bunun insülin direnci ve diyabet ile komorbiditesinden kaynaklanıyor olabileceği de ileri sürülmüştür. Günlük kalorinin protein ve karbonhidrat yerine büyük oranda yağdan alındığı beslenme biçimi obezite riskini arttırarak dolaylı yoldan kognitif bozulmaya ve AH gelişimine neden olabilir. Yağdan zengin beslenmenin Aβ ya da tau üzerinden etki göstermediği BDNF düzeylerini azaltarak oksidatif gerilimi arttırdığı ve sinaptik plastisitede kayba neden olduğu bildirilmiştir. Yüksek glisemik bir diyetle beslenme insülin direnci ve diyabet gibi önemli AH risk faktörlerinin ortaya çıkmasına neden olmaktadır. Yüksek glisemik bir diyetin Aβ birikiminde artışla korele olduğu gösterilmiştir.
Buna karşılık Akdeniz diyeti bir koruyucu faktör olarak en popüler çevresel faktör araştırma konularından biridir. Akdeniz diyeti (MeDi) ile tahıllar, sebzeler, meyveler, peynir, süt, özellikle balık, zeytinyağı ve kırmızı şaraptan zengin bir diyet kastedilmektedir. Columbia Üniversitesi MeDi Çalışması, New Yorkta MeDi uyumuna göre düşük, orta ve yüksek olarak sınıflandırdığı 1393 normal yaşlının MCI ve 482 MCIlının demans geliştirme sonlanma noktalarında yüksek uyum grubunun düşük uyum grubuna göre avantajlı olduğunu göstermiştir. Rotterdam ve Chicago Sağlık ve Yaşlanma Projesi gibi 2 büyük çalışmada balık tüketiminin daha yavaş kognitif bozulmayla ilişkisi gösterilmiştir. MeDinin hücre içi reaktif oksijen türevlerini, apoptozu ve telomer kısalması gösteren hücreleri azaltarak oksidatif gerilimi azalttığı gösterilmiştir. AHden korunmada özellikle zeytinyağında bulunan polifenollerin etkin olduğu, natürel sızma zeytinyağında bulunan oleuropein aglikonun otofajiyi tetiklediği, protein birikintilerini ve enflamasyonu azalttığı, AHde kognitif fonksiyonu geliştirdiği gösterilmiştir. Başka bir zeytinyağı ürünü olan hidroksitirosolün de antioksidan ve anti-enflamatuvar özellikleri bulunduğu ve fare çalışmalarında mitokondrial oksidatif gerilim, enflamasyonu ve apoptozu azalttığı gösterilmiştir.
Kafa travması öyküsü ile AH arasında ilişki bildiren önemli çalışmalar olmakla birlikte (örneğin, EURODEM) bunu red edenler de vardır (örneğin, Rotterdam Çalışması ve Kanada Sağlık ve Yaşlanma Çalışması). Bilinç kaybına neden olmuş şiddetteki kafa travmaları (BKKT) ilk yıldan itibaren demans için bir risk faktörü olarak bildirilmiştir. BKKT öyküsü olan bireylerde olmayanlara göre demans riskinin %24 daha fazla olduğu, ağır bir BKKT (başlangıçta Glasgow koma skalası 3-8 arası ve ardından uzamış bilinç kaybı) öyküsü AH riskini %35 arttırırken, tek ılımlı bir BKKT öyküsünün (30 dakikadan kısa süren bilinç kaybı) AH riskini %17 arttırdığı bildirilmiştir. Demans riski BKKT sayısıyla da artmaktadır. 2-3 BKKT öyküsü riski %33 arttırırken, 4 BKKT öyküsü %61, 5 ve daha fazla BKKT öyküsü %183 oranında arttırmaktadır. APOE-ε4 yükü ile kafa travmasının AHnin başlangıç yaşı üzerine birlikte etkisi olduğunu ileri süren çalışmalar mevcuttur. Bir çalışmada kafa travması tek başına etkisiz görünürken, normalde iki misli artmış olan APOE-ε4 heterozigotlarının riskini 10 misline arttırdığı ortaya konmuştur. Kafa travmasının ilk etkisi fokal ya da difüz aksonal hasardır, ardından oksidatif gerilim, enflamasyon, nöronal eksitotoksisite gibi mekanizmalarla nöron kaybına ve bunun sonucunda kognitif bozulmaya yol açar. Ayrıca BKKTnin ardından saatler içerisinde Aβ birikimi olduğu gösterilmiştir. BKKT hastalarının post-mortem incelemesinde Aβ plakları ve NFYler yaklaşık üçte bir oranında görülmüştür. Ayrıca BKKT hastalarında BOSta tau düzeylerinin arttığı da gösterilmiştir. Dementia pugilistica geliştiren boksörlerin otopsilerinde saptanan gevşek neokortikal amiloid plaklar da bu varsayımı destekler niteliktedir.
Depresyonun AH için bir risk faktörü mü yoksa AHnin erken bir semptomu mu olduğu konusu tartışmalıdır. Depresyon başlangıç yaşına göre erken-yaş-depresyonu (EYD) (60 yaşından önce başlayan) ve geç-yaş-depresyonu (GYD) (60 yaşından daha sonra başlayan) olarak sınıflandırıldığında GYDnin AH riskini 1,65 kat kadar arttırdığı gösterilmiştir. Hayatı boyunca majör depresyon öyküsü olan bireylerde Aβ birikiminin arttığını gösteren bir çalışma mevcuttur. Komorbid depresif semptomları bulunan MCI hastalarının da AHye dönüşme hızlarının depresif semptomları bulunmayanlara göre daha yüksek olduğu ve Aβ yüklerinin de daha fazla olduğu gösterilmiştir.
Uyku bozukluğunun kognitif bozukluk, MCI ve demans için risk faktörü olduğu öne sürülmüştür. Uykunun Aβ klirensini arttırdığı, bu nedenle uyanık kişilerde interstisyel Aβ konsantrasyonunun uyuyanlara oranla daha yüksek olduğu gösterilmiştir. Sadece bir gece akut uyku yoksunluğunun beyinde Aβ düzeylerini arttırdığı gösterilmiştir. Ayrıca uyku interstisyel sıvı tau düzeylerini de düşürmektedir. Uyku yoksunluğu olan hastaların BOS tau düzeylerinde de %50 artış gözlenmiştir. Uyku-uyanıklık siklusunun bozulması AHnin en erken semptomlarından biri de olabilir. Yani uyku bozukluğu ile AH arasındaki nedensellik karşılıklı gibi görünmektedir. Uyku-uyanıklık siklusu bozukluğunun tedavisi AH patolojik sürecini yavaşlatabilir.
Alkol ve AH patolojisi ilişkisi tartışmalı bir konudur. Birçok çalışmada hafif-orta alkol tüketiminin koruyuculuğu bildirilmiş, giderek bu etkinin bir U eğrisi sergilediği, yüksek tüketimde kaybolduğu ileri sürülmüştür. Ilımlı düzeyde alkol alımının AH riskini azalttığı fakat ağır içiciliğin [erkekler için günde 4ten ya da haftada 14ten fazla, kadınlar için ise günde 3ten ve haftada 7den fazla sayıda alkollü içecek tüketiminin] artmış riskle ilişkili olduğu bildirilmiştir. Koruyuculuk açısından alkollü içkiler içinde özellikle kırmızı şarap üzerinde durulmaktadır. Kırmızı şarabın içerdiği polifenoller ve özellikle de bir uzun ömür faktörü olarak sirtuin sinyallemesinde rol oynayan resveratrol Aβ agregasyonunu inhibe etmekte, oksidatif gerilim ve enflamasyonu azaltmakta ve protein homeostazını dengeliyor gibi görünmektedir. Bu açıdan demans riskini azaltmada düşük dozlarda şarap tüketimi önerilebilir.
Ayrıca, zihinsel ve fiziksel aktivitenin koruyuculuğundan söz edilebilir. Normal koşullarda demansı olmayan yaşlı bireylerin hippokampuslarında her yıl %1-2 hacim kaybı görülebilir. Orta yoğunlukta 1 yıl süren bir egzersiz programının hippokampus hacim kaybını durdurmakla kalmayıp, hacmi %2 oranında arttırdığı gösterilmiştir. Fiziksel aktivite plastisiteyi aktive ederek, beyin vaskülarizasyonunu ve nörogenezisi arttırarak, enflamasyonu ve amiloid plak formasyonunu azaltarak kognisyon üzerinde olumlu etkiye sahiptir. Ayrıca bir yandan vasküler riskin kontrolü aracılığıyla, diğer yandan da eğitim için olduğu gibi zengin uyarana maruz kalmanın kognitif rezervi arttırması yoluyla etki ediyor olabilir. Osteoporotik Fraktürler Çalışmasında uzunlamasına izlenen 6000 65 yaş üzeri kadın arasında en fazla yürüyen üst çeyrek, en az yürüyen alt çeyrekle karşılaştırıldığında, 6-8 yıl sonra daha az kognitif kayıp sergilemekteydiler. Colcombe ve Kramerin meta-analizinde (2003) egzersize tabi tutulan sedanter yaşlıların tutulmayanlarla karşılaştırıldığında kısa süreli kognitif düzelme sergiledikleri ortaya konmuştur. Yüksek düzeyde fiziksel aktivite gösteren bireylerde AH riski sedanter yaşama sahip olanlara kıyasla yarıya düşmektedir (RR = 0,72 tüm demans türleri için ; RR = 0,55 AH için). Fiziksel aktivite AHyi önlemekle kalmayıp AH hastalarında günlük yaşam aktivitelerine katılımla değerlendirilen klinik kötüleşmeyi yavaşlattığı gösterilmiştir.
Çok sayıda çalışma, okumak, sanatsal faaliyette bulunmak, oyun oynamak gibi zihinsel aktivite gösteren yaşlıların AH geliştirme risklerinin daha düşük olduğunu ileri sürmektedir. Wilson ve arkadaşları Chicagoda ortalama 5,3 yıl izledikleri 4000 yaşlı arasında, kognitif olarak stimüle edici faaliyetlere daha sık katılan yaşlıların daha düşük ihtimalle kognitif bozulma sergilediklerini gösterdiler. Zihinsel aktivite de daha zengin kognitif rezerv oluşturarak etki ediyor olabilir. Kısıtlı sosyal ilişkiler de Kungsholmen, İsveç ve Kuzey Manhattan, ABD gibi önemli toplum temelli kesitsel ve uzunlamasına gözlem çalışmalarında bağımsız bir risk faktörü olarak ortaya konmuştur. Sosyal ilişkiler akraba ve arkadaş ilişkilerinin zenginliği, sinema, lokanta, klüp, dernek faaliyetleri amaçlı sokağa çıkmalar olarak özetlenebilir. Honolulu-Asya Yaşlanma Çalışmasında bu risk orta yaşlarından itibaren sosyal aktiviteleri düşen bireylerle sınırlı bulunmuştur.
Küçük kafa çevresi ile AH arasında bazı çalışmalarda gösterilen ilişki, eğitim ile olan ilişkide olduğu gibi kognitif rezerv teorisiyle açıklanmaya çalışılmaktadır.
Hipotiroidinin gerek genel olarak demans ve gerekse de AH ile ilişkisi ortaya konmuştur. AH ile ilişkisinin mekanizması aşikar olmasa da potansiyel olarak düzeltilebilir bir durum olması bakımından önemlidir.
TAPS çalışmasında elektro-manyetik alan (EMF) maruziyeti de AH için bir risk faktörü olarak ortaya konmuştur. Elektrikçiler, tamirciler, santral operatörleri, teknisyenleri, kaynakçılar, marangozlar, terziler gibi elektrikli aletlerle çalışanlar aşırı düşük frekanslı (ELF) EMF maruziyeti için risk altında meslek gruplarıdır. Bizim çalışmamızı da içeren ELF-EMF maruziyeti ve AH ilişkisi ile ilgili 12 çalışmanın meta-analizi olan bir çalışmada bu ilişkinin bağımsız bir risk olduğu kabullenilmekle birlikte mevcut çalışmalarda maruziyet dozu ile risk artışı ve maruziyet ile cinsiyetlerin ilişkisinin belirlenememiş olması dolayısıyla daha fazla çalışmanın gerektiğinin altı çizilmiştir. Maruz kalınan diğer toksik ve zararlı durumlar arasında organik çözücüler, alüminyum ve genel anestezi ön plana çıkar gibi görünmektedir. Ancak bunların yerleşmiş tutarlılıkta bulgular olduğu söylenemez.
AH ile açıkça ilişkili bulunan çeşitli risk faktörleri ve koruyucu faktörler hastalıktan primer korunma çalışmalarının ilgi odağı olmuştur. Özellikle dejeneratif hastalıklarda oksidatif gerilim ve eksitotoksisite mekanizmalarının açıklayıcı olarak devreye girmesinden sonra, bu mekanizmaları tersine çevirdiği iddia edilen terapötik ajanların popülaritesi de artmıştır. Antioksidan olarak selenyum ve E vitaminiyle yapılan çalışmalarda etki gösterilememiştir. Anti-enflamatuvar ajan kullananlar arasında AH sıklığının daha az olduğu birçok gözlemsel çalışmada gösterilmiştir. Bu bulgu, söz konusu ajanların AHdeki enflamatuvar süreci tersine çevirmeleri şeklinde yorumlanmıştır. Ancak, özgül olarak sağlıklı yaşlılarda demans gelişimini engellemek veya AHlilerde hastalık seyrini yavaşlatmak amaçlı tasarlanan anti-enflamatuvar klinik çalışmaları başarılı olamamıştır. Balık yağı, omega-3, B vitamini, Acetyl-l- carnitine ve folik asit tüketiminin de hastalığı önleyebileceği üzerinde durulmuş fakat çalışmalar başarılı olamamıştır.
Östrojen replasmanı kullanan post-menopozal kadınlarda AHnin daha az görülmesi, östrojenin koruyuculuğu üzerine yoğun bir tartışma başlatmıştır. Ancak, Kadın Sağlığı İnisiyatifi çalışmasında yaşlı kadınlarda östrojen replasmanının jinekolojik kanserlerde artmanın yanısıra, demans riskini düşürmek bir yana tam tersine arttırdığı bulunmuştur. Kolesterol düşürücü ilaçlar, özellikle de statin grubu kullananlarda AH prevalansı kullanmayanlara göre daha düşüktür. Son zamanlarda bu etkinin kolesterol düşürücü etkinin ötesinde, statinlerin doğrudan α-sekretaz proteolitik yolunu uyararak, sAPP oluşumunu arttırmalarıyla ilintili olduğuna ilişkin deneysel deliller bulunmuştur. Yine de, AHlilerde klinik çalışmalarda sınanan statin tedavisinin faydası gösterilememiştir.
Anti-hipertansif ve anti-diyabetiklerin vasküler risk faktörlerinin kontrolü aracılığıyla demansa karşı koruyucu olabileceği sağduyuyla da çıkarımlanabilir. Nitekim, bu öngörü anti-hipertansifler açısından birkaç prospektif çalışmada doğrulanmıştır. Yukarda değinildiği gibi IDE Aβ klirensinde bir şaperon olarak işlev gördüğü bilinmektedir. İnsüline dirençli tip II diyabetiklerde, IDE beyinde işlev görmek yerine periferde artan insülini parçalamak için kullanılmaktadır. Dolayısıyla, özgül olarak insülin direncini düşürerek işlev gören peroksizom proliferatörü ile aktive reseptör gama (PPAR-γ) agonistleri sınıfı anti-diyabetikler vasküler risk kontrolü yanısıra potansiyel olarak özgül anti-Alzheimer etki de gösterebilirler. Fakat klinik çalışmalarda başarılı olamamıştır.
Genetik
AHde genetik faktörler büyük oranda hastalığın gelişimi için çevresel faktörlere bir yatkınlık zemini yaratacak şekilde birer risk faktörü niteliğindedirler. Tüm AH olgularının sadece %1-2si basit Mendelyen OD geçişle hastalığa yakalanırlar. OD-AHliler tipik olarak erken başlangıçlı (60 yaş öncesi) hastalığa sahiptirler.
Genetik açıdan genel olarak kompleks nörolojik bir hastalık olarak nitelenmesinin yanısıra, AH Mendelyen geçiş açısından da heterojenite gösteren polijenik/multialelik bir hastalıktır: birden fazla kromozomdaki gen lokuslarının çok sayıda farklı mutasyonları aynı hastalığa yol açar. OD geçişten sorumlu olan şimdiye kadar 3 ayrı gen bulunmuştur: amiloid prekürsör protein (APP) geni (APP, 21. kromozom), presenilin 1 geni (PSEN1, 14. kromozom) ve presenilin 2 geni (PSEN2, 1. kromozom).
Bu genlerin kodladığı 3 protein de transmembran proteinlerdir. Bu proteinlerden presenilin 1 (PS1) ve presenilin 2 (PS2) APPnin katalitik proteolizinde görev alan üç sekretazdan biri olan ve APPyi transmembran domeninden kesen γ-sekretaz kompleksinin aktif katalitik ünitesini alternatifli olarak oluşturan proteinlerdir (%90 PS1, %10 PS2). Anılan genlerdeki mutasyonlar her durumda APP proteolizini Aβ fragmanının üretiminin artışına neden olacak yola kaydırırlar. APP mutasyonu taşıyan aileler çok az sayıda olsa da, bu mutasyonlar bir yandan amiloid metabolizması üzerinden hastalığın patogenezine ışık tutarken, bir yandan da Down sendromu ile AH arasındaki ilişkiyi de aydınlatmıştır. Bilindiği gibi Down sendromlular 21. kromozomun 3 kopyasını taşırlar (21 trizomisi). Dolayısıyla, ömürleri boyunca APP proteolizinden üretilecek daha fazla Aβyı temizlemek zorundadırlar. Down sendromlular otuzlu yaşlardan itibaren hemen daima AHnin nöropatolojik değişikliklerini göstermeye başlarlar.
OD-AH ile ilişkilendirilen ilk mutasyon John Hardy tarafından 1991 yılında bildirilen APPnin yanlış anlamlı (missense) bir mutasyonudur (V717I). Enteresan biçimde, aynı gendeki bir başka mutasyon bir yıl önce Hollandalı tipi amiloidozlu serebral hemoraji ile ilişkilendirilmişti (G693Q). Biriken veriler serebral amiloid anjiyopatiye neden olan mutasyonların APPnin ortalarına, proksimal kısmı transmembran domene, distal kısmı ekstraselüler domene rasgelen 40-42 amino asitlik β-amiloid bölgesinin içinde kümelenirken, OD-AHye neden olanların biri dışında tümünün daha proksimalde γ-sekretaz kesim bölgesini tutarak Aβ42 üretimini arttırdıkları, bir mutasyonun ise distalde β-sekretaz kesim bölgesinde hem Aβ40, hem de Aβ42 üretimini arttırdığını göstermektedir. St. George Hyslop 1995 yılında PSEN1 genini klonlayarak bu gendeki AHye neden olan mutasyonu tanımladı. PS1 yukarda değinildiği gibi APPnin γ-sekretaz proteolizine aracılık etmek yanısıra embriyogenez sırasında nöral gelişimde temel sinyalleme sistemi olan NOTCH sinyalizasyonuna aracılık etmektedir. Aynı yıl içinde bu kez Schellenberg grubu tarafından PS1 ile %80 homoloji taşıyan PS2yi kodlayan PSEN2 geninde OD-AHye neden olan mutasyon tanımlandı. PSEN1 mutasyonları tüm OD vakaların %80ini oluştururken, PSEN2 %5ini ve APP mutasyonları %15ini oluşturmaktadır. PSEN1 için 200den fazla, PSEN2 için yaklaşık 16 tane ve APP için 50den fazla mutasyon tanımlanmıştır Her 2 gendeki mutasyonlar da γ-sekretaz aktivitesini etkileyerek Aβnın daha toksik formu olan Aβ42 üretiminin artmasına neden olmaktadırlar. OD-AH aileleri genç yaşta ortaya çıkmaları (PSEN1, 25-60 yaş; APP, 40-65 yaş; PSEN2, 45-84 yaş) yanısıra, bellek dışı bir çekirdek sendromla ve/veya erken davranışsal özellikler, miyoklonus ve nöbetler şeklinde atipik klinik tablolarla da çıkabilirler. AHnin ilk bildirilen olgusunun erken başlangıçlı, davranışsal belirtilerin ön planda olduğu bir tabloya sahip olduğu hatırlandığında, Auguste D.nin böylesi bir genetik varyasyona sahip olması ihtimali üzerinde durulmuş ve bu olgunun saklanan dokusundan yapılan bir çalışmada PSEN1 mutasyonu taşımadığı ve APOE genotipinin ε3/ε3 olduğu bulunmuştur. Genel olarak PSEN1 aileleri APP ailelerine göre daha atipik ve daha kısa süreli ve ağır demans sergilerlerken, PSEN2 aileleri daha fazla sporadik AHye benzeyen ve daha yavaş seyirli hastalık tablolarına sahiptirler.
Şimdiye kadar tanımlanan mutasyonlar ailesel AHnin %50 kadarını oluştururlar ve yoğun araştırmalara rağmen yeni bir Mendelyen geçiş geninin bulunamaması dikkat çekicidir. Anılan üç genle bağlantılandırılamayan AH aileleri olduğuna göre henüz bulunmayan genler ve OD olmayan geçiş biçimleri ileri sürülebilir.
ApoE proteinini kodlayan gen (APOE, 19. kromozom), mutasyonlarıyla doğrudan belirleyici değil fakat polimorfizmiyle sporadik AHde risk faktörü olarak ortaya konmuştur. Kolesterolün taşınmasında rol oynayan bir protein olan ApoE, toplam 299 rezidüsünün ikisinde arjinin ve/veya sistein bulunmasıyla farklılaşan üç ayrı alelik forma sahiptir: ε2, ε3 ve ε4. Kuzey Amerika ve Kuzey Avrupadan normal popülasyonlarda en sık ε3 (%70-80) görülürken, ε4ün sıklığı %10-20, ε2ninki ise %5-10dur. AHde ε4 sıklığı ikiye katlanarak %40-50ye ulaşır. ε4 AH riskini doza bağlı bir şekilde arttırır ve hastalık başlangıç yaşını azaltır. AlzGene veritabanında (2007) beyazlar ve Japonlarda ε4 heterozigotlarında AH riski, ε3 homozigotlarına göre ihtimaliyet oranları (ORler) sırasıyla 3 ila 4 olacak şekilde artmıştır. ε4 homozigotlarında hastalık heterozigotlarına göre daha erken başlar ve risk, ORler aynı gruplarda bu kez sırasıyla 11.8 ve 21.8 olacak şekilde artar. Ayrıca, OR-AHde de ε4 varlığı hastalık başlangıç yaşını erkene alır. ε4 homozigotlarının yaşam boyu kümülatif risklerinin %90 olduğu hesaplanmıştır.
ε4 sıklığı ve patolojik rolü için coğrafi farklılıklar ileri sürülmüştür. Bizim de katıldığımız bir görüşe göre Avrupada kuzeyden güneye sıklığı azalacak şekilde bir gradyan mevcuttur. Örneğin, ε4 sıklığı normal popülasyonda kuzeyde Finlandiyada %24 bulunurken, güneyde Yunanistanda %5,6 gibi küçük bir orana kadar inmektedir. Biz TAPS çalışmasının olgu-kontrollü kısmında ε4 sıklığını normal kontrollerde %8,2, buna karşılık AH grubunda %14,7 bulduk. ε4 OR, 2,21 gibi AlzGenede bildirilenlerden daha düşük olmakla birlikte yine de anlamlı bulundu. ApoE alel sıklığını dünya çapında bir meta-analizde ele alan Corbo ve Scacchi (1999) bu gradyan ve ε4ün bir AH riski oluşturmasında gözlenen etnik ve coğrafi farklılıklar için akla yakın bir açıklamada bulundular: ε3, Akdeniz Havzası gibi kadim bir tarım uygarlığına sahip insan topluluklarında en sık alel gibi durmaktadır (%84,9-%89,8). Ataların aleli denebilecek olan ε4, Pigmeler (%40,7), Bantular (%37,0), Malezya ve Avustralya aborjinleri (%24 ve %26), Papua Yeni Gineliler (%36,8) ve Laplar (%31) gibi avcı-toplayıcı ekonominin hala mevcut, besin kaynaklarının göreli olarak kısıtlı olduğu halklarda sık olsa da başta Sahra-altı halklarda olmak üzere bir AH riski değildir. Yazarlar, ε4ün Batılı diyet, daha uzun yaşam süreleri gibi çağdaş çevresel koşullara maruziyetinin, bazı işlevsel özelliklerine dayanarak onu AH için bir yatkınlık aleli haline dönüştürmüş olabileceğini ileri sürdüler. Öyle görünüyor ki gerek Aβ klirensinde ve gerekse de nöronal plastisitede rejenerasyon ve onarımda rol oynayan APOEnin bu rolünde ε4, ε2 ve ε3e göre daha başarısız olmaktadır. Amiloid PET görüntüleme ve BOSta amiloid düzeyi ölçümleriyle gösterilen amiloid birikimi ε4 izoformunda en yüksek, ε2 izoformunda ise en düşüktür. Nöroplastisite mekanizmalarındaki rolünü yansıtacak şekilde, ApoE nakavt farelerde sinaptik yoğunlukta yaşa bağımlı bir azalma görülür (gelişimsel nöroplastisite). Kafa travması, serebrovasküler hastalık gibi beyin hasarlarından sonra ε4 taşıyıcıları daha kötü prognoz gösterirler (onarımsal nöroplastisite).
Şimdiye kadar incelenen APOE-ε4 dışı hiç bir polimorfizmin etki büyüklüğü ε4 ORlerine yaklaşamamıştır. Bertram ve arkadaşlarının AlzGene veritabanını kullanarak yaptıkları bir meta-analizde (2007) bağlantı analiziyle o zamana kadar 69 gende bildirilen 127 polimorfizm incelenerek 13 gendeki 20 polimorfizm pozitif olarak değerlendirilmiş ve ortalama risk ORleri 1,25, ortalama koruyucu ORleri 0,85 olarak bulunmuştur. Bu 20 polimorfizm arasından özellikle anjiyo-tensin konverting enzim (ACE), GRB2 asosiye bağlayıcı protein 2 (GAB2) ve transferrin (TF) genlerindeki polimorfizmler küçük etkilerine rağmen en az 10 çalışmada doğrulanmış göreli olarak büyük örneklem sayılarıyla dikkate değer ek risk faktörleri olabilirler. Son zamanlarda üstünde durulan başka bir yatkınlık geni de sortilin ilişkili reseptör genidir (SORL1). SORL1in APPnin hücre yüzeyinden Golgi-endoplazmik retikulum kompleksine naklinde rol oynadığı bilinmektedir. SORL1 ifadesinin azalması Aβ artışına neden olmaktadır. Lee ve arkadaşlarının gözden geçirdiği üzere büyük örneklemlerdeki alelik asosiasyon çalışmasında 1,4 ila 2,2 arasında ORler saptanmıştır. Genom Boyu Asosiasyon Çalışması (GWAS) bağlantı analizinden farklı olarak bir genetik lokus ile hastalığın ilişkisini önceden teorik olarak varsaymak gerekmeksizin, tüm genomun analizi aracılığıyla binlerce hastalık büyük hasta örneklemlerini kontrollerle karşılaştırıp hastalık grubunda anlamlı olarak daha sık görülen varyasyonları ortaya koymaya dayanır. 2009 yılında tamamlanan 2 büyük GWAS çalışmasının ilkinde 5000i aşkın hasta ve 10000i aşkın kontrolün analizinde Harold ve arkadaşları clusterin (önceden APOJ olarak bilinen) geni (CLU) ve 11. kromozomda bulunan phosphatidylinositol bağlayan clathrin asamble proteini geni (PICALM) ile anlamlı ilişkiler bildirdiler. Nature Geneticsin aynı sayısında yayınlanan 2. GWAS çalışmasında 5000den fazla hasta ve kontrol bireylerinde Lambert ve arkadaşları 8. kromozomda bulunan CLUdaki lokusu doğrularken, bu kez 1. kromozomdaki kompleman bileşeni reseptörü 1 geninde (CR1) bir lokus daha gösterdiler. Bu 3 genin kodladığı proteinlerin de Aβ klirensinde rol oynadığı düşünülmektedir. Ardından 2010 yılında Seshadri ve arkadaşları 35.000den fazla katılımcıyla yaptıkları GWAS çalışmasında CLU, PICALM ve yeni olarak BIN1 ve EXOC3L2/BLOC1S3/MARK4 lokuslarını gösterdiler. Yine 2010 yılında Jun ve arkadaşlarının yaptıkları metaanaliz LOAD ile CR1, CLU ve PICALM ilişkisini vurguladı. 2011 yılında yapılan GWAS çalışmasında CR1, CLU, BIN1 ve PICALMa ek olarak MS4A4A, CD2AP, EPHA1, ve CD33 olmak üzere 8 anlamlı genetik ilişki gösterildi. Afro-Amerikanlarda yapılan bir GWAS çalışmasında ise CLU, PICALM, BIN1, EPHA1, MS4A4A, ABCA7, CD33 ve APOEye ek olarak beyazlarda bulunmayan PROX1, P4HA3, ZC3H3, TMTC1 ve ENOX genleri tanımlandı. 2013 yılında yapılan geniş bir metaanalizde ise APOE, BIN1, CLU, CR1 ve PICALM ve bunlara ek olarak AH ile ilişkili olabilecek SORL1, CASS4, FERMT2, HLA-DRB5-DRB1, INPP5D, ve MEF2C lokusları gösterilmiştir. SORL1 ve CASS4 APP yolağı üzerinden, CASS4 ve FERMT2 tau üzerinden, HLA-DRB5-DRB1, INPP5D ve MEF2C immün fonksiyon ve enflamasyon üzerinden ve SORL1 lipid transportu ve endositozda rol oynuyor olabilir. Tüm bu yeni lokuslar için AH riski APOE ε4 varyantına göre düşüktür.
TREM2 (triggering receptor expressed on myeloid cells 2 protein) beyinde makrofaj ve dendritik hücrelerde immün yanıtı tetikleyen bir proteindir. Homozigot mutasyonuna bağlı fonksiyon kaybı Nasu-Hakola hastalığına neden olmaktadır. Fakat heterozigot nadir varyantlarının da AHye yatkınlık yarattığı gösterilmiştir. 2013 yılında Guerreiro ve arkadaşları tarafından yürütülen, birimimizin de dahil olduğu bir çalışmada, 1092 AH hastası ve 1107 kişiden oluşan kontrol grubu TREM2 varyantları açısından karşılaştırıldı. Bu çalışmada AH ile ilişkili saptanan birçok TREM2 varyantından en güçlü ilişkiyi R47H varyantında gözlenmiştir (OR = 4,5). Bu varyantın AH riskini arttırdığı ve ayrıca 80-100 yaşları arasında bu mutasyona sahip olmayan ve Alzheimer hastası olmayan katılımcıların kontrol grubuna oranla daha zayıf kognitif fonksiyona sahip olduğu da gösterilmiştir.
Öyle görünüyor ki, her şeye rağmen yeni yatkınlık genlerinin araştırılması ve bulunanların doğrulanmasına yönelik yoğun çabalar sürecektir. Bu konunun bir özeti için Tablo 4e bakınız.
Tablo 4. Alzheimer hastalığının genetiği (Robinson ve ark., 2017; Karch ve ark., 2015, Karch ve ark., 2014; Guerreiro ve ark., 2013)
|
Gen ve Proteini |
Kromozom |
Risk |
Mekanizma |
|
APP Amiloid prekürsör protein |
21q21.3 |
Tam penetrans |
Hasar yanıtı/Amiloid kaskadı Aβ40 ve Aβ42 üretiminde artış |
|
PSEN1 Presenilin 1 |
14q24.3 |
Tam penetrans |
Amiloid kaskadı Aβ42 üretiminde artış |
|
PSEN2 Presenilin 2 |
1q31-q42 |
Tam penetrans |
Amiloid kaskadı Aβ42 üretiminde artış |
|
APOE Apolipoprotein E |
19q13.2 |
ε4: 3,68 (3,30-4,11) ε3: 0,62 (0,45-0,85) |
Kolesterol/lipid metabolizması Aβ klirensinde bozulma |
|
ADAM10 α-secretase A Disintegrin And Metalloprotease 10 |
15q21.3 |
Bulunamadı |
APP işlenmesi |
|
DSG2 Desmoglein 2 |
18 |
0,73 |
Hücre-hücre bağlantılarının düzenlenmesi |
|
CD2AP- CD2-assosiye protein |
6p12 |
1,1 |
Reseptör endositozu ve sitokinezi |
|
SORL1 Sortilin ilişkili reseptör |
11q23.2-q24.2 |
1,10 (1,03-1,17) |
Endositoz ve kargo, lipid taşınması Aβ üretiminde artış |
|
TREM2- Triggering receptor expressed on myeloid cells 2 |
6p21.1 |
2,55 |
İmmün yanıt; kronik enflamasyon |
|
PLD3 Fosfolipaz D3 |
19q13.2 |
2,75 |
Klatrin aracılı endositoz Patofizyolojideki tam etkisi bilinmiyor. |
|
CASS4 Cas scaffolding protein family member 4 |
20q13.31 |
0,88 |
APP ve Tau patolojisi; Hücre iskeleti fonksiyonu ve aksonal taşınma |
|
FERMT2- Fermitin family member 2 |
14q22.1 |
1,14 |
Anjiogenez, Tau patolojisi |
|
ABCA7 ATP-binding cassette, subfamily A (ABC1), member 7 |
19p13.3 |
1,15 |
Kolesterol/lipid metabolizması; immün ve kompleman sistemleri/enflamatuvar yanıt |
|
RIN3 Ras and rab interactor 3 |
|
0,91 |
Nöral gelişim, sinaps fonksiyonu ve endositoz |
|
SLC24A4- Solute carrier family 24), member 4 |
14q32.12 |
0,91 |
Nöral gelişim, sinaps fonksiyonu ve endositoz |
|
CR1 Kompleman bileşeni (3b/4b) reseptörü 1 |
1q32 |
1,18 (1,09-1,28) |
İmmun ve kompleman sistemleri Aβ klirensinde bozulma |
|
HLA-DRB5-DRB1- Major histocompatibility complex, class II, DR B5-B1 |
6p21.3 |
1,11 |
İmmün yanıt ve enflamasyon |
|
ZCWPW1- Zinc finger, CW type with PWWP domain 1 |
7q22.1 |
0,91 |
Epigenetik düzenleme |
|
CD33 sialic acid binding immunoglobulin (Ig) like lectin |
19q13.3 |
0,94 |
İmmün ve kompleman sistemleri |
|
CELF1- CUGBP, Elav-like family member 1 |
11p11 |
1,08 |
Hücre iskeleti fonksiyonu ve aksonal taşınma |
|
EPHA1- EDH reseptör A1 |
7q34 |
0,9 |
İmmün ve kompleman sistemleri |
|
PICALM Phosphatydinilinositol bağlayıcı klatrin asamble proteini |
11q14 |
0,87 (0,83-0,91) |
Klatrin aracılı endositoz Aβ klirensinde bozulma |
|
CLU Clusterin |
8p21-p12 |
0,86 (0,82-0,89) |
İmmun ve kompleman sistemleri Aβ klirensinde bozulma |
|
PTK2B- Protein tirozin kinaz 2 beta |
8p21.1 |
1,1 |
Hippokampal sinaptik fonksiyon; hücre göçü |
|
NME8- NME/NM23 family member 8 |
7p14.1 |
0,93 |
Hücre iskeleti fonksiyonu ve aksonal taşınma |
|
MS4A4A6A membrane-spanning 4A gene cluster |
11q12.1 |
0,9 |
İmmün ve kompleman sistemleri |
|
MS4A4A4E |
11q12.2 |
0,9 |
İmmün ve kompleman sistemleri |
|
BIN1- Bridging integrator 1 |
2q14 |
1.22 |
Sinaptik vezikül endositozu |
|
MEF2C- Myocyte enhancer factor 2C |
5q14.3 |
0,93 |
İmmün yanıt ve enflamasyon; Hippokampal sinaptik fonksiyon |
|
INPP5D- Inositol polyphosphate-5-phosphatase, 145kDa |
2q37.1 |
1,08 |
İmmün yanıt ve enflamasyon; APP metabolizması |
Koyu Kırmızı: Tam penetrans
Kırmızı: Yüksek risk
Turuncu: Orta risk
Yeşil: Düşük risk
Yukarıdan aşağı yaklaşık olarak toplumdaki sıklığına göre artan şekilde sıralanmıştır.
NÖROPATOLOJİ
Nörodejeneratif hastalıklar (proteinopatiler), genetik ve/veya çevresel faktörlerin etkisiyle normal işlev gören bir hücresel proteinin fiziksel konformasyonunu değiştirerek kendi üstüne katlanması (β-katlı tabaka oluşumu) ve böylece birikerek oligomerleşme ve klirense dirençli hale gelmesi şeklinde bir ortak mekanizmaya sahiptir. β-katlanma sonucu birbirlerine lateral olarak en az 2-3 hidrojen bağlarıyla bağlı β-iplikçikleri oluşur. Bir β-iplikçiği tipik olarak 3 ila 10 amino asitlik bir polipeptid zinciridir. Hidrojen bağları iplikçikler arasında bir çeşit omurga oluşturur.
Tüm nörodejeneratif hastalıklar ya da biyokimyasal perspektiften proteinopatiler, geleneksel isimlerinin yanısıra biriken proteinin adıyla anılırlar (örn., LCD bir α-sinükleopatidir). Bu açıdan AH benzersiz bir şekilde bir çifte proteinopatidir. Dolayısıyla, AHyi bir amiloidopati (zamansal olarak önce biriken protein) olarak da taupati (klinik bulguların iticisi olan protein) olarak da sınıflamak doğru olmayacaktır. Pick hastalığı, KBD, PSP gibi nörodejeneratif hastalıklar tekil taupatilerdir ama AH bir amiloidozlu taupatidir.
Primer patolojiler olan AP ve NFYler yanısıra gliozis-enflamasyon, nöron ve sinaps kayıpları, aksonal ve dendritik morfolojik değişiklikler, kortikal kolinerjik innervasyon ve diğer nörotransmitter sistemlerinde kayıplar AH nöropatolojisinin eşlikçi bileşenlerini oluştururlar.
![]() Amiloid
Plaklar ve Amiloid-β
Fizyopatolojisi
Amiloid
Plaklar ve Amiloid-β
Fizyopatolojisi
NFYlerin tersine yükleri hastalık şiddetiyle korele etmeyen senil plakların (Şekil 3) ana bileşenlerinin amiloid beta peptidi (Aβ) olduğu 1984ten beri bilinmektedir (yani, senil plak = amiloid plak). Aβ, 21. kromozomda kodlanan bir transmembran protein olan amiloid prekürsör proteininin (APP) katabolizma ürünlerindendir. APP geninin yok edildiği transjenik farelerde (APP nakavt) nöral plastisitede rolü olabileceğini düşündüren ılımlı bulgular mevcuttur. APP yokluğu onun gibi davranan ve amiloid prekürsör benzeri proteinler adı verilen APLP1 ve APLP2 tarafından kompanse ediliyor olabilir. Nitekim, APP/APLP2 çifte nakavtlar sağ kalamamaktadır.
Şekil 3. Amiloid Plak (Kaynak: http://www-edlib.med.utah.edu/WebPath/CNSHTML/CNS090.html)
Bütün transmembran proteinlerde olduğu gibi APPnin de bir hücre içi karboksi ucu (CT), bir membran kateden parçası, bir de hücre dışı amino ucu (NT) vardır (Şekil 4). 770, 751 ve 695 rezidülük üç izoformu olan APPnin intramembranöz parçası 700-723. rezidülere rastlar. β-amiloid, 671 ila 711-713. rezidüler arasında yer alan 40 veya 42 rezidülük, distal kısmı ekstraselüler, proksimal kısmı intramembranöz yerleşmiş bir parçasıdır. APP bir dizi proteolitik enzimle kesilerek metabolize edilir. Bu enzimlere α, β ve γ-sekretaz adları verilir. α-sekretaz APPyi tam da Aβnın ortalarına rastlayan 687. ekstraselüler bölgede keser. Bu kesim sonunda distalde parenkime atılan çözülebilir APP ya da sAPPα adı verilen ekstraselüler parça oluşurken geride hala membrana bağlı 83 rezidülük C-terminal fragmanı-α (CTF-α) kalır. sAPPαnın hücre kültürlerinde nörotrofik etkileri bulunmuş ve APP nakavt transjeniklerdeki plastisite defisitlerini geri çevirdiği gösterilmiştir. Oysaki, alternatif distal kesimi yapan β-sekretaz enzimi APPyi Aβyı salim bırakacak şekilde, ekstraselüler bölgede α-sekretazın daha distalinden 671. pozisyondan keserek akson budanması ve dejenerasyonuna neden olduğu düşünülen distal parça sAPPβyı parenkime atar ve geride salim Aβ fragmanını da içeren 99 rezidülük membrana bağlı CTF-βyı bırakır.
Proksimal kesme ise intramembranöz bölgede γ-sekretaz enzimi aracılığıyla sekansiyel olarak yapılır. γ-sekretaz CTFyi ilk olarak 720/721. pozisyondan epsilon (ε) kesimine uğratır ve nükleer sinyallemede rol oynadığı bulunan amiloid intraselüler domeni (AICD) isimli fragman sitoplazmaya salınır. İkinci olarak 717. pozisyondan zeta (ζ) kesimi ve nihayet üçüncü olarak ağırlıkla 711, daha az olarak 713. pozisyondan gamma (γ) kesimi yapar. γ-sekretaz CTF-αyı γ-kestiğinde distalde bu kez parenkime Aβ fragmanının budanmış ve zararsız p3 adı verilen parçacığı atılır. Buna karşılık, γ-sekretaz CTF-βyı γ-kestiğinde 711 veya 713. pozisyonlardan kesilmeye göre daha ağırlıkla daha kolay klirensi sağlanan Aβ40, daha az oranda da, daha toksik formu olan Aβ42 fragmanı, yani klirensi başarıyla sağlanamazsa oligomerleşip, sonra fibrilize olup nihayet amiloid plaklarda birikecek materyal ortaya çıkar (Şekil 4).
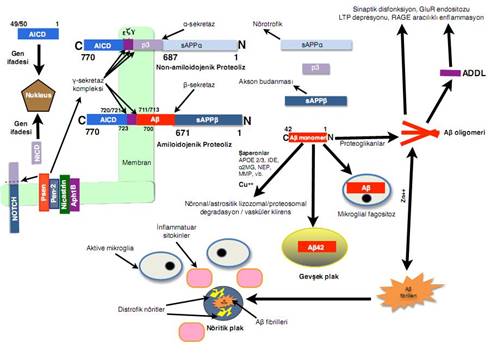
Şekil 4. APP proteolizi ve Aβ birikimi.
Amiloid prekürsör protein (APP) 770 aminoasidlik (aa) bir transmembran (TM) proteindir. 700 ve 723. aalar membranı kateden parçasına rasgelir. Aβ karboksi ucuna (CT) yakın 40-42 aalık bir fragmanıdır. Aβnın 700 ila 711-713. aalara karşılık gelen kısmı membran içinde (transmembran domen TMD), 671 ila 699. aalar arasında kalan kısmı ise ekstraselüler (jukstamembran domen JMD) yerleşimlidir. APP proteolizi distalde ekstraselüler parçada amiloidojenik veya non-amiloidojenik olarak yapılır. Amiloidojenik proteoliz Aβ fragmanını salim bırakacak şekilde 671. pozisyondan β-sekretaz kesimiyle başlatılır. Bu kesim amino ucunda (NT) akson budanmasında rol oynadığı bulunan sAPPβ ve CTde membrana bağlı 99 aalık (C99) fragmanı oluşturur. Non-amiloidojenik proteoliz ise APPyi Aβ-JMD içinden, 687. pozisyondan kesen α-sekretaz aracılığıyla başlar. Bu kesim de NTde nörotrofik etkileri bilinen sAPPα ve CTde yine membrana bağlı 83 aalık (C83) fragmanı oluşturur. C99 ve C83 intramembranöz parçada γ-sekretaz kompleksi (GS) ile bir dizi ardışık kesimden geçer. İlk kesim ε kesimi adı verilen 720 veya 721. pozisyonda meydana gelir. Oluşan 49-50 aalık APP intraselüler domeni (AICD) isimli fragmanın hücre çekirdeğine transloke olarak protein sentezini desteklediği bilinmektedir. İkinci kesim ζ kesimidir ve 717 veya 718. pozisyonda ve nihayet 3. kesim olan γ kesimi 711 veya 713. pozisyondadır. Bu son kesim non-amiloidojenik C83te ise ortama 24-26 aalık inert bir budanmış Aβ parçacığı olan p3, amiloidojenik C99da ise 40-42 aalık salim bir Aβ fragmanı üretir. GS APPnin yanısıra bir dizi TM proteinin daha proteolizinden sorumlu olan bir aspartil proteaz kompleksidir. Aktif katalitik bölgesi presenilin 1 veya 2 (PSEN) olmak üzere 4 ayrı proteinin bileşimidir (Pen-2, Nicastrin, Aph1B). GSnin diğer önemli proteolitik hedefi nöro-gelişimde önemli rol oynayan NOTCH proteinidir. GS kesimi sonrası NOTCH intraselüler domeni (NICD) adı verilen fragman, gen ifadesini ve hücresel farklılaşmayı başlatmak üzere nukleusa transloke olur. Ortama salınan Aβ monomerleri mikroglial fagositozla temizlenebilecekleri gibi şaperon moleküller tarafından vasküler endotelden klirensi sağlanabilir veya yine şaperon moleküller tarafından lizozomal veya proteozomal degradasyona maruz kalacakları nöronlar ve astrositler içine sokulur. Bu yöntemlerin herhangi biriyle ortamdan uzaklaştırılamayan, özellikle de potansiyel olarak daha toksik form olan Aβ42 gevşek plaklarda birikir. Bu son savunma mekanizması da başarısız kaldığı takdirde Aβ monomeri çözülebilir oligomerler halinde bir araya gelir. Çözülebilir oligomer bir dizi sinaptik disfonksiyon mekanizmasını tetikleyerek AHnin en erken fizyopatolojik özelliği olan LTP depresyonuna neden olur. Oligomerler daha toksik ADDLlere budanabilecekleri gibi çözülemeyen Aβ fibrillerine doğru da evrilebilirler. Aβ fibrilleri de hücre yıkıntı ürünleri olan distrofik nöritlerle birlikte nöritik plaklarda hapsedilirler. Fibriler Aβ gibi nöritik plaklar da kararlı yapılar olmaktan çok toksik oligomerler için bir tür rezervuar işlevi görmektedirler. Nöritik plaklar çevrelerinde oksidatif gerilim yanısıra aktive mikroglia aracılığıyla enflamasyona yol açarlar.
Normal yaşlanmada α-sekretaz aktivitesi baskınken, AHde denge β-sekretaz alternatifine kaymaktadır. OD-AH özellikle Aβ42 üretimini arttırırken, başta APOE olmak üzere bütün yatkınlık genleri Aβ klirensini etkileyerek risk oluşturmakta veya koruyucu olmaktadırlar. α-sekretaz aktivitesini çok sayıda transmembran proteinin proteolizinde görevli olan bir disintegrin ve metalloproteinaz (ADAM) ailesinden bir dizi metalloproteinazın yerine getirdiği bilinmektedir. Bunlar arasında en aktiflerinden biri ADAM17 olarak da bilinen tümör nekrotizan faktör-α çevirici enzim (TACE), diğeri ADAM10dur. β-sekretazın 11. kromozomdaki geni bulunmuş ve BACE (beta-site APP cleaving enzyme) adı verilmiştir. BACE nakavt farelerde kayda değer bir değişiklik olmamakla birlikte APP/PS1 gibi son derece virulan bir AH transjeniği ile çaprazlaştırılan BACE nakavt farelerin soyunda, plak birikimi için BACEin temel önemde olduğunu gösterecek şekilde birikim olmamaktadır. Bu da β-sekretaz inhibisyonunu çekici bir tedavi hedefi kılmaktadır. γ-sekretazın ise aktif katalitik bölgesinde presenilini (PS1 veya PS2) de içeren ayrıca nikastrin, APH-1 ve PEN-2 isimli proteinlerden oluşan bir proteaz kompleksi olduğu bilinmektedir. Daha önce de söz edildiği gibi γ-sekretaz aynı zamanda nöro-gelişimde temel olan NOTCH sinyalizasyonunda da rol oynamaktadır ve PS1 nakavt fareler ağır gelişimsel kusurlar sergileyerek sağ kalamamaktadırlar.
Parenkimdeki yaklaşık 4 kilo Daltonluk (kD) Aβ monomerleri kendi başına zararsızdır ve mikroglia tarafından doğrudan fagositoza maruz bırakıldıkları gibi APOE alelik formları, insülin degrade edici enzim (IDE), α2-makroglobulin (α2-MG), neprilizin ve matriks metalloproteinaz (MMP) gibi proteinleri içeren bir dizi şaperon moleküle bağlanıp, düşük dansiteli lipoprotein reseptörü ilişkili protein (LRP-1) aracılığıyla astrosit ve nöronlara internalize edilerek otofaji ve proteozomal degradasyona maruz bırakılırlar. LRP1 farklı hücre tiplerinde Aβnın internalizasyonu için bir kapıcı olarak düşünülebilir ve nitekim vasküler endotelinden sirkülasyona aktarılarak temizlenmeye de aracılık eder. Degradasyon ve klirens aracılığıyla başa çıkılamayan miktarlardaki monomerler bir araya gelerek dimer ve tetramerler şeklinde moleküler ağırlıklarını arttırarak (8-20 kD) çözülebilir Aβ oligomerlerini oluşturacaklardır. Bu çözülebilir oligomerlere düşük moleküler ağırlıklı Aβ (LMW Aβ) adı da verilir. Oligomerler parçalanarak daha toksik olan amiloid betadan türeyen difüze olabilen ligandlara (ADDLlar) değişebilirler veya toplanmayı sürdürerek bir sonraki aşamada artık çözülemeyen protofibrilleri ve giderek toksik fibrilleri oluştururlar. ADDLa değişme, glutamik asit siklaz (QC) enziminin oligomerleri glutamik asit konumlarında piroglutamatlaması ile olur. Oligomerin N-terminusundan itibaren 3. ve 11. pozisyondaki glutamik asitin piroglutamatlanması sırasıyla [Aβ (3(pE)-42)] ve [Aβ (11(pE)-42)] şeklinde gösterilen ADDL formlarını oluşturur. Toksik potansiyeli en fazla biçim olduğunun gösterilmesinden sonra QC inhibisyonu çekici bir tedavi hedefine dönüşmüştür. Aβ fragmanının önce oligomerizasyonu, sonra da fibrilizasyonuna amino ucuna yakın bir konumda bulunan ağır metal bağlayıcı bölgelerinin aracılık ettiği düşünülmektedir. Buna göre, Cu++ bağlanması oligomerizasyon, Zn++ bağlanması fibrilizasyon için gereklidir. Zn++ yanısıra metal bağlayıcı bölgenin yakınlarındaki proteoglikan polisakkarid makromolekülleri bağlayan başka bir bölgenin de fibrilojenezde etkili olduğu bildirilmiştir. Fibriler Aβ plaklara hapsedilecektir.
İlk birikim NFYlerin tersine limbik sistemde değil, neokortekste ve gevşek (difüz) plaklar şeklindedir. Bu plaklardaki amiloidin büyük çoğunlukla fibriler değil granüler Aβ oligomerlerini içerdikleri bulunmuştur. Gevşek plaklar kognitif bozukluk geliştirmeden ölmüş olan yaşlı beyinlerinde de büyük miktarlarda görülebilir. Geçen yüzyılda bu bulgular AH nöropatolojik değişikliklerinin normal yaşlanmada da görülebileceği şeklinde yorumlanırken, bugün artık bu bireylerin hastalığın pre-klinik evresinde ölmüş subklinik AH-P hastaları olduğunu biliyoruz. Ayrıca, çok sayıda immünositokimyasal çalışma ile gevşek plak içeriğinin daha toksik ve birikime yatkın başlıca Aβ42 formu olduğunu görülmüştür. Dolayısıyla, plak oluşumu Aβ monomerinden birikime doğru giderek daha toksik formlara giden bir patogenetik mekanizmanın daha nihai evresinden çok bir savunma mekanizması olarak düşünülebilir: degradasyon ve klirens mekanizmalarıyla Aβ40 ile başa çıkılmakta, bu mekanizmalar Aβ42 için yetersiz kaldığında plak formasyonu yoluna gidilmektedir.
Buna karşılık diğer plak formu olan katı (kompakt) plaklar çekirdeğini fibriler Aβnın oluşturduğu plaklardır. Bu aşamadan sonra dejenere distrofik nöritler içeren katı plaklara nöritik plaklar (NP) adı verilir. NPler immün cevabı tetikleyerek mikroglia ve astrosit aktivasyonu ile TNF-α ve IL-β gibi sitokinlerin salınımı, kompleman aktivasyonu ve serbest radikal oluşumuna neden olurlar. Bu immün aktivasyon nörotoksisitenin başlıca etmenlerindendir gibi durmaktadır. NPler yalnızca demanslı beyinlerde görülür. Nöritik bileşen sinaptik artık ve nörofilamanlardan oluşur ve çoğu aynı zamanda tau-çift sarmallı filamanları (τ-PHF) için de pozitif immünoreaksiyon gösterir. PHF(+) plaklarda nöritik bileşenin NFY içeren akson kalıntıları olduğu söylenebilir. Böylelikle bölgesel olarak farklı başlangıç yatkınlıklarına sahip olan NFY ve APler hastalığın seyri içinde PHF(+) plaklarla birlikte yan yana gelmiş olurlar. Nöritik plaklar tam boy Aβ40 ve Aβ42nin her ikisini de içerdikleri gibi ADDLleri de içerirler. Bunlar arasında yukarda en toksik olduğu söylenilen amino ucundan budanmış Aβ (3(pE)-42 formunun demans şiddetine korele edecek şekilde Braak ve Braak evre IV-VI boyunca nöritik plak kompozisyonundaki oranı giderek artar. Bu bulgu da yalnızca demanslı beyinlerde görülen bu daha olgun plak formunun da bizzat kendisinin bir tetikçi olmasından çok alternatif savunma mekanizmalarının çok yetersiz kaldığı nörodejenerasyonun bu ileri aşamalarına özgü bir ek savunma girişimi olduğunu düşündürmektedir. Son zamanlarda Aβnın özellikle Aβ (3(pE)-42 formu ile yalnızca ekstraselüler parenkimal plaklarda değil, agrezom adı verilen intranöronal birikintilerde de biriktiğine dair çalışmalar artmaktadır. Bu çalışmalar sonucunda intranöronal birikimin sinaps ve nöron kaybına neden olan, ekstraselüler plak birikimini önceleyen erken bir fenomen olduğu ileri sürülmüştür. Bu yeni bulgular ışığında Aβ monomerinden nöritik plağa doğru evrim eski perspektifle olduğu gibi giderek daha zararlı bir forma doğru çizgisel bir evrilme şeklinde değil de toksik Aβ oligomeri ile farklı aşamalarda başa çıkma stratejileri olarak görülmelidir. Degrade edilemeyen toksik Aβnın fibrilizasyonu ve sonrasında da plaklara hapsolunması toksisitesinin giderilmesine yönelik önlemler olmakla birlikte, bu çözülemeyen birikintilerle çözünür oligomerik formlar arasında sürekli bir dinamik dengenin mevcudiyeti aslında bu formların toksik biçimler için sürekli bir rezervuar işlevi görmeleri anlamına gelmektedir. Aβ oligomerinin yol açtığı sinaptik disfonksiyon ve giderek nöron kaybını önceleyen ve aşan sinaps kaybı mekanizmalarına aşağıda değinilecektir.
AP yükünün AHde demans şiddetiyle korele etmediğini gösteren nöropatolojik çalışmaların ötesinde, PIBden başlayarak PET amiloid ligandlarının geliştirilmesinden sonra AP yükünün bir kısım kognitif yakınması olmayan yaşlılar ve bir kısım MCIlılarda AH tanısı almış demanslılar düzeyine yaklaştığı, hatta AP yükü açısından AHye benzeyen MCIlıların uzunlamasına izlemlerinde demansa dönüştükleri, bir kez demans geliştikten sonra ise AP yükünün fazlaca değişmediği ortaya konmuştur. PET ile ölçülen amiloid yükü esas olarak MCIdan da önce pre-klinik aşamada ilerleyici olarak artıyor, pre-demans MCI ve demans aşamalarında ise büyük ölçüde değişmeyecek denge durumuna ulaşıyor gibi durmaktadır. Amiloid yükü kognitif bozukluk şiddetiyle korele etmese de AH-Pden AH-Kya dönüşme olasılığıyla korele etmektedir. Amiloid PET görüntülemenin bu yüzyılın ilk onyılında erişilebilir olması nöropatolojinin o tarihe kadar ortaya koyamadığı bir hakikati de berrak biçimde ortaya koymuştur: amiloid birikimi o zamana kadar sanıldığı gibi belli bir coğrafi yatkınlık göstermeden yaygın neokortikal özellikte değil fakat öncelikle beynin orta hat yapılarını tutmakta ve bu yapılarda ağırlığını giderek arttırmaktadır. Bu yatkınlık olağan durum ağı DMN ile büyük ölçüde örtüşmektedir.
DMN hipokonnektivitesi daha pre-klinik evrede olan AH-P hastalarında, hatta kognitif olarak normal ve amiloid negatif oldukları gösterilmiş ε4 taşıyıcılarında rsMRG ile saptanabilmektedir. Bu ilk bakışta şaşırtıcı bulgu amiloid PET ligandlarının fibriler Aβ ve plaklar gibi çözülemez formlara bağlanmaları, oysaki görüntülenemeyen çözülebilir Aβ formlarının nöral ağlarda sinaptik disfonksiyon yapmak için yeterli olması ve bunun da özellikle ve öncelikle DMNde olması şeklinde yorumlanabilir. Yukarda tartışıldığı gibi, Aβ klirensini sağlayacak bir şaperon molekül olan APOEnin klirenste inefektif olan ε4 aleli ortamda daha fazla Aβ42 ve ADDL olmasına neden olacak ve bunlar da amiloid PETin saptama duyarlılığından kaçacaklardır. Beynin istirahat durumundaki enerji tüketiminin %80i glutamat siklusuna dayanır ve bu enerjinin büyük bölümü aerobik glikolize bağlı oksidatif fosforilasyonla üretilir. DMN bu varsayımsal istirahat durumunda aslında çok aktif olduğuna göre buralarda Aβ varlığı nedeniyle koruyucu bir önlem olarak artabilecek aerobik glikoliz ve giderek bu artış talebinin karşılanamaması bu orta hat yapılarının Aβ birikimine yatkınlığını açıklayabilir.
Alzheimer Hastalığı Kayıtlarını Oluşturma Konsorsiyumu (CERAD) 1991 yılında NP sıklığının yarı-nicel değerlendirmesine dayanan bir evreleme sistemi önerdi. Yok, seyrek, orta, sık olarak derecelendirilen NP sıklığı üç ayrı kortikal alanda bakılır: orta frontal girus, superior ve orta temporal giruslar, inferior parietal lobül. Derecelendirme bireyin yaşına göre evrelendirilir (Evre 0, A, B, C). 50 yaş altı bireylerde Az ve üstü dereceler Evre C olarak sınıflandırılır. 50-75 yaş arasında Orta ve üstü dereceler Evre C olarak sınıflandırılır. 75 yaş üstü bireylerde Sık NP Evre C, Orta NP Evre B, Az NP Evre A sınıfına girer. Yok derecesi daima Evre 0 olur. Evre 0 AHnin histolojik delillerinin olmaması, Evre A, AHye dair kesin olmayan histolojik deliller; Evre B, AHyi telkin eden histolojik deliller; Evre C, AHyi gösteren histolojik deliller olarak yorumlanır.
Thal ve arkadaşları tarafından 2002 yılında yapılan otopsi çalışmasıyla beyinde Aβ yayılımının nöropatolojik aşamaları tanımlanmıştır. Buna göre Aβ depozitleri Faz 1de sadece neokortekste görülürken, Faz 2de allokortikal bölgeler (entorhinal alan, insular korteks, amigdala, singulat girus, presubikular bölge gibi), Faz 3te diensefalik çekirdekler, striatum, bazal ön beyin kolinerjik çekirdekleri, Faz 4te beyinsapı çekirdekleri ve Faz 5te serebellar tutulum görülür. Yazarlar demanslı olmayan bireylerin Faz 1-3, demanslı bireylerin Faz 3-5 arası olduklarını bildirdiler. Bu sınıflama AHde serebral amiloidoz için Thal Evrelemesi olarak yerleşmiştir.
Aşağıda değinilecek olan NIA-AA AHnin nöropatolojik değerlendirilmesi rehberinde hem Thal evrelemesi hem de CERAD derecelendirilmesinin kullanılması önerilmiştir.
Nörofibriler Yumaklar
NFYlerin (Şekil 5) temel bileşeni hiperfosforile tau (τ) proteinidir. τ 17. kromozom tarafından kodlanan mikrotübül asosiye proteinler (MAP) ailesinden bir proteindir (MAP-τ). Kargo veziküllerinin hücre gövdesinden akson terminaline anterograd ve bunların degradasyon ürünlerinin akson terminalinden geriye hücre gövdesine retrograd nakliyesinde önemli roller oynayan mikrotübüller başlıca MAP-τ ile stabilize edilir. MAP-τ görevi bir demiryolunda rayları paralel stabilize eden traverslerin işlevlerine benzetilebilir. Stabilizasyonu bozulmuş bir mikrotübül sistemi ile nakliye işlevi de mümkün olmayacaktır. Kargo vezikülleri eskiyen yapıların replasmanı ve sinaptik aktivite için gerekli protein ve enzimleri içerir. Mikrotübüller tau-tubulin etkileşimi ile stabilize olabilen labil yapılardır. Bu etkileşim tau proteininin izoformuna ve fosforilizasyon durumuna bağlıdır.
Tau proteini karboksi ucunda mikrotübüllere bağlanma bölgesi sayısına göre üçü üç tekrar (3R), üçü ise dört tekrar (4R) taşıyan toplam altı izoforma sahiptir. 4R tau mikrotübül stabilizasyonunda daha etkindir. İkincil mesajcıların uyarımı post-sinaptik nörondaki tüm intraselüler proteinleri olduğu gibi tauyu da protein kinazların aktivitesiyle fosforile eder. Fosforile tau mikrotübülden ayrılır. Yine bütün fosforile intraselüler proteinler gibi tau da işlev bittikten sonra fosfatazlar aracılığıyla defosforile edilmelidir ki yeniden mikrotübüle bağlanabilsin. Fosforile taunun defosforilasyonundan başlıca sorumlu fosfataz protein fosfataz 2Adır (PP2A). AH patogenezinde hiperaktif kinazlar ve/veya hipoaktif fosfatazlar tau proteininin hiperfosforilizasyonuna yol açarak mikrotübüllere bağlanma yeteneğini bozarlar. Bu kinazlar arasında özellikle glikojen sentetaz kinaz 3βnın (GSK-3β) yalnız AHde değil, diğer taupatilerde de patolojik hiperfosforilasyondan sorumlu olan enzim olduğu üzerinde durulmaktadır. Bağlanmamış hiperfosforile tau monomerleri fiziksel konformasyonlarını değiştirerek kendi üzerlerine katlanırlar (β-katlanma) ve toksik oligomerlere dönüşürler. Tau oligomerleri bir sonraki aşamada yine toksik çözülemeyen çift sarmallı filamanlara (PHF) polimerize olurlar. PHFler ısı şoku proteinleri ve başlıca ubikuitin proteozom sistemlerinin devreye girmesiyle giderek intranöronal NFYler şeklinde kondanse olurlar (Şekil 6). Dendritik PHF birikimlerine nöropil iplikçikleri (neuropil threads NT) adı verilir. NFYlerin, APlere benzer şekilde, toksik PHFlerin etkisini sınırlamaya çalışan bir savunma mekanizması olduğu giderek geçerlilik kazanan bir görüştür. Yetersiz bir savunma olan NFY ile sonunda hücre iskeleti bütünlüğü ve aksonal nakliye bozularak hücre ölümü meydana gelir. Hücre ölümüyle ortaya çıkan ekstraselüler NFYye hayalet yumak adı verilir. NFYden hayalet yumağa geçişin yılları kapsayan uzun bir süreç olduğu düşünülmektedir.
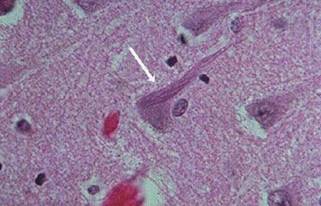
Şekil 5. İntraselüler Nörofibriler Yumak (Kaynak: http://www-edlib.med.utah.edu/WebPath/CNSHTML/CNS094.html)
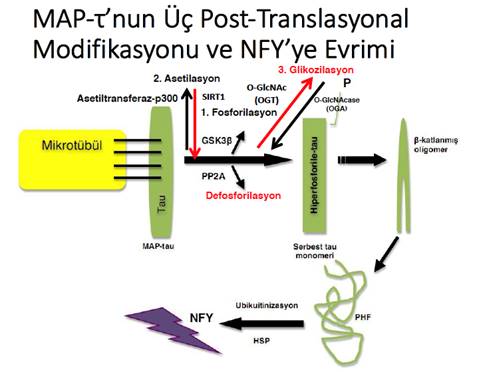
Şekil 6. Mikrotübül asosiye tau proteinin NFYye evrimi. Üç veya dört tekrar bölgesinden mikrotübüle bağlı olan tau proteini hiperaktif kinazlar (özellikle GSK3β) ve/veya hipoaktif fosfatazların (özellikle PP2A) varlığında hiperfosforile olarak mikrotübüllerden serbestlenir. Serbest tau patolojik olarak katlanarak oligomerleşir. Oligomerler çift sarmallı filamanlara (PHF) kondanse olurlar. PHF ise ısı şoku proteinleri (özellikle HSP90) ve proteozomal ubikütinizasyon sistemi aracılığıyla NFYlere hapsolurlar.
GSK3β: glikojen sentetaz kinaz 3β; HSP: ısı şoku proteini; MAP: mikrotübül asosiye protein; NFY: nörofibriler yumak; P: fosfor; PHF: çift sarmallı filaman; PP2A: protein fosfataz 2A
Fosforilasyonun tau disfonksiyonu için tek başına yeterli post-translasyonel mekanizma olmadığı, asetilasyon ve glikozilasyonun fosforilasyonu veya defosforilasyonu destekleyen diğer mekanizmalar olduğu artık yerleşik bilgidir. Asetilasyon histon-asetiltransferaz-p300 enzimi, deasetilasyon ise sınıf III protein deasetilaz SIRT1 tarafından yapılır. Asetile tau defosforilasyona daha dirençli hale gelmektedir. AH beyinlerinde erken ve orta Braak evrelerindeki taupatide tau asetilasyonunun arttığı gösterilmiştir. Asetilasyon enzimini inhibe etmek, SIRT1e ise agonistik davranmak AHde çekici tedavi hedefleri olabilir. Glikozilasyon tau toksisitesi açısından (benzer şekilde Aβ toksisitesinden de) koruyucu bir post-translasyonel mekanizma gibi durmaktadır. Glikolizasyon β-N-asetilglukozamin (O-GlcNAc) enzimi ile gerçekleşir; deglikolizasyonu ise N-asetilglukozaminidaz (O-GlcNAcase) sağlar. AH tipik olarak serebral glikoz metabolizmasının bozulduğu bir nörodejenerasyondur ve bu metabolizma bozukluğunun koruyucu post-translasyonel mekanizmayı da bozduğu düşünülebilir. Benzer şekilde O-GlcNAc agonizması da bir tedavi hedefi olabilir.
NFYler beyinde rasgele değil fakat belli bir bölgesel yatkınlığı yansıtacak şekilde yerleşirler. Normal yaşlılık sürecinde limbik (entorhinal ve hippokampal) NFY sayısıyla kronolojik yaş arasında korelasyon gösterilmiştir. Braak ve Braakın I ve II. evrelerine karşılık gelen bu aşamanın normal kognisyondan sübjektif bellek yakınmalarına geçişin nöral altyapısı olduğu ileri sürülebilir. En erken değişiklikler entorhinal korteksin II. piramidal tabakasında (ECx-II) oluşmaktadır. ECx limbik sistemin dış dünyayla arayüzü olarak değerlendirilebilir. Lateral sektörü (LECx) infero-temporal girus ve perirhinal cortex (PRC) aracılığıyla gelen nesne ve yüz bilgisini, mediyal sektörü (MECx) posterior parietal korteks ve parahippokampal girus (PHG) aracılığıyla gelen bağlam ve mekan bilgisini paralel olarak hippokampal formasyona sunar. Hatırlanmak üzere kaydedilmesi gereken her türlü yeni bilgi limbik sisteme ECx II aracılığıyla girer ve bu tabakadaki nöronların aksonları perforan traktusu (PT) oluşturarak ECxi hippokampal formasyonun giriş kapısı denilebilecek olan dentat girusunun (DG) granüler tabakasına bağlarlar. DG ile lokal entrensek hippokampal devreye (EHD) girilmiş olur (Şekil 7A). EHD içinde trisinaptik bir uzun yol ve bu yol üzerindeki bir veya daha fazla durağa uğramadan kestirmeden daha ilerdeki duraklara bağlanan daha kısa yollar bulunur. Trisinaptik uzun yolda DG yosunsu lifler aracılığıyla Ammon boynuzunun 3. sektörünün (CA3) piramidal tabakasına bağlanır. Schaffer kollateralleri bu kez CA3ü CA1e bağlarlar. CA3 sahip olduğu Schaffer liflerinden ayrılarak kendi üzerine geri dönen oto-asosiyatif lifleri ile EHD içinde benzersiz bir anatomik yapıdır (Şekil 7B). CA1 ise subikuluma (SUB) bağlanır. SUB, EHDnin çıkış kapısı konumundadır; ECx alt tabakalarına (IV-VI) bağlanarak EHD kapanacak ve ECx IV-VI işlenmiş limbik bilgiyi multimodal asosiasyon kortekslerine geri bildirebilecektir. Kestirme yollara ilk örnek PTden ayrılan bir kollateralin DGyi atlayarak doğrudan CA3le bağlanmasıdır. ECx-IIIten çıkan bir efferent ise PTye katılmadan doğrudan CA1e hatta bu efferentin bir kollaterali doğrudan son durak olan SUBa bağlanır. Bu alternatif yolaklar gelmekte olan bilgi ne kadar yeni ise uzun yolu kullanmalı, ne kadar aşina ise EHDyi kısa yoldan dolaşabilmeli şeklinde yorumlanabilir. SUB aynı zamanda geniş boyutlu Papez devresinin (Şekil 7C) de hem başlangıcı hem de devrenin dönüp kendi üstüne kapandığı çıkış kapısıdır. Papez devresi ise SUBdan fimbria-fornix aracılığıyla hipotalamusun mamiller cisimciklerine (CM) olan bağlantıyla başlar. CM, mamillo-talamik traktus (MTT) aracığıyla talamusun limbik çekirdekleri de denilen anterior grup çekirdeklerine bağlanır. Talamus anterior grubu posterior singulat girusla (pCG), ve retrosplenial girusla (rSG) talamo-kaudal singulat traktus (TKST) aracılığıyla bağlantılıdır. rSGden SUBa ventral singulum (vCING) aracılığıyla olan bağlantılarla Papez devresi kapanır. Papez devresi içinde de LECx ve MECx lokal devresindeki özelleşme daha geniş bir şekilde izlenir: bağlam ve mekan belleğinden sorumlu bir postero-mediyal sistem (PMS) ve nesne ve yüz belleğinden sorumlu bir anterior temporal sistem (ATS). PMS, DMNnin posterior düğümü precuneus ile bağlantılı DMN anterior düğümü (ventromediyal prefrontal korteks) ve lateral düğümünü (anguler girus) PHG aracılığıyla MECxe bağlar. ATS ise temporopolar korteks (TPCx), lateral orbitofrontal korteks (lOFCx) ve amigdalayı PRC aracılığıyla LECxe bağlar. Ranganath ve Ritchey 2012 tarihli derlemelerinde PMS ve ATSnin göreli özelleşmelerinin EHD içinde DG-CA3 bağlantısallığında entegre edildiğini ileri sürmüşlerdir. Maass ve arkadaşları 2019 yılında serebral amiloid yükünün PMS disfonksiyonu olarak yorumlanabilecek şekilde ön planda sahne belleğinde, tersine serebral tau yükünün ATS disfonksiyonu olarak yorumlanabilecek şekilde ön planda nesne belleğinde bozukluğa neden olduğunu gösterdiler.
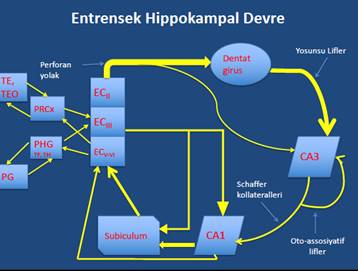
Şekil 7A. Entrensek Hippokampal Devre. Multimodal asosiasyon alanları ECxin üst tabakaları ile ileri besleme bağlantılarına sahiptir. ECx II moleküler tabaka nöronlarının aksonları perforan yol aracılığıyla DGnin granüler tabakasına bağlanır. DG yosunsu lifler aracılığıyla CA3 piramidal tabakasına, CA3 ise Schaffer kollateralleri aracılığıyla CA1e bağlanır. CA1 ise EHDnin çıkış kapısı konumunda olan subikuluma bağlanır. Subikulum ECx alt tabakalarına bağlanır ve EHD kapanmış olur. Ayrıca perforan yoldan ayrılan bir kollateral DGyi atlayarak doğrudan CA3le bağlanırken, ECx-IIIten çıkan bir efferent ise doğrudan CA1e hatta bu efferentin bir kollaterali doğrudan son durak olan subikuluma bağlanır.
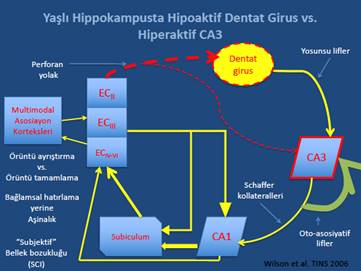
Şekil 7B. Transenthorinal NFY evresinde Perforan Yolak Disfonksiyonu ve CA3 kompansasyonu. CA3ün %95 girdisi kendi oto-asosiyatif lifleri aracılığıyladır. NFY patolojisi ECxII dejenerasyonuna ve dolayısıyla DG diskonneksiyonuna neden olduğunda multisinaptik uzun yol fonksiyonu bozulur. Bunun sonucunda CA3 oto-asosiyatif liflerinde kompansatuar bir hipertrofiyle epizodik bellekteki eksikliği aşinalık ile kompanse etmeye başlayacaktır.
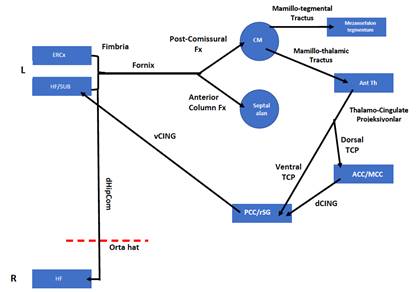
Şekil 7C. Epizodik Bellek için Papez Devresi. Papez devresi subikulumdan fimbria-fornix aracılığıyla hipotalamusun mamiller cisimciklerine olan bağlantıyla başlar. CM, mamillo-talamik traktus aracığıyla talamusun anterior grup çekirdeklerine bağlanır. Talamus anterior grubu posterior singulat girusla ve retrosplenial girusla talamo-kaudal singulat traktus aracılığıyla bağlantılıdır. rSGden subikuluma ventral singulum aracılığıyla olan bağlantılarla Papez devresi kapanır.
PRCx: perirhinal kortex, PHG: parahippocampal girus, ECx: entorhinal korteks, Ant. Th: talamus anterior grup çekirdekler; CA1 ve 3: cornu ammonis 1 ve 3; CM: corpus mamillare; DG: dentat girus; rSG: retrosplenial girus, HF: hippokampal formasyon, dHipCom: dorsal hippokampal kommissur, vCING: ventral cingulum, Fx: fornix, TCP: talamosingulat projeksiyon, ACC: anterior singulat korteks, MCC: mediyal singulat korteks.
AHde nörodejenerasyonun ağırlığı ve süresiyle paralel biçimde NFYnin önceden görüldüğü bir bölgedeki yoğunluğu artarken o bölgeyle bağlantılı olan komşu bölgeye transsinaptik olarak yayılır. Dolayısıyla, ECxII dejenerasyonuyla DG diskonneksiyonu büyük ölçüde yenilik bilgisinin değerlendirildiği multisinaptik uzun yolu disfonksiyonel kılar. Bunun sonucunda DG girdilerini yitiren CA3 oto-asosiyatif liflerinde kompansatuar bir hipertrofi izlenir. CA3 aşırı aktivitesinin sonucu olarak değişerek reorganize olan entrensek hippokampal devre artık yenilik bilgisini epizodik bellekte eski deneyimler dolayısıyla kaydedilmiş bilgiyle karşılaştırarak yeniliği aşina olandan ayırt etmede yetersiz kalacağından (örüntü ayrıştırma bozukluğu), henüz salim kalmış kestirme yolları sayesinde bu eksikliğini aşinalık ile kompanse edecektir (örüntü tamamlama). SCIdaki bellek bozukluğunun nöropsikolojik karşılığı yenilik işleme bozukluğu ve aşinalık kompansasyonu, nöral temeli ise CA3 reorganizasyonu olabilir. Braak ve Braak 1995 yılında, Iden VIya sıraladıkları evreler boyunca NFYlerin entorhinal kortekste (transentorhinal evreler I ve II) görülmeye başlayıp önce EHD ve akabinde Papez devresine yayıldıkları (limbik ve paralimbik evreler III ve IV), sonunda da heteromodal asosiasyon alanlarına (neokortikal evreler V ve VII) yayılıp sayılarının artışını izleyen bir evreleme sistemi geliştirdiler. Yazarlar, 2011 NIA-AA söylemini öngörmüşçesine Evre I-IIye klinik olarak sessiz olgular, Evre III-IVe başlangıç halinde Alzheimer hastalığı, Evre V-VIya tam olarak gelişmiş Alzheimer hastalığı adı verdiler. Evre I-IVte amiloidozsuz izole taupati olguları görülebilirken Mesulam, Braak ve Braak sistemine paralel bir klinikopatolojik korelasyon evrelemesi önererek NFY yayılımını normal yaşlanmadan (EvreI/II), MCI (Evre III/IV), hafif ve ağır demans evreleri (Evre V/VI) sürekliliği içinde izler. Bu evreler boyunca entrensek hippokampal devrenin ve Papez devresi yapılarının giderek daha fazla NFY ile yüklendikleri ilerleyici süreç AHnin KN-SCI-MCI-demans sürekliliği boyunca merkezi ilerleyici bellek bozukluğu tipik fenotipinin de açıklamasıdır.
Nöropatolojide fosfo-tauya spesifik immünhistokimyasal tekniklerin (AT8) kullanılmaya başlanmasıyla Gallyas gibi klasik gümüş boyalarıyla boyanmayan intranöronal fosfo-tau birikintileri saptanabilir olmuştur. Arjirofilik NT/NFY niteliğinde olmayan ve ancak immün reaksiyon pozitivitesi ile saptanabilen (AT8-IR) bu patolojik tau birikintilerine Braak ve arkadaşları ön-yumak (pretangle) adını vermiştir. Ön-yumaklar PHF öncesi fosfo-tau oligomerleri olarak düşünülebilir. Baskın olarak veya tümüyle 4R tau özelliği gösterirler. Ön-yumakların transentorhinal korteksten dahi yıllar önce beyinsapında görülmesi Braak ve arkadaşlarını 1995 evrelemesini modifiye etmek durumunda bırakmıştır. Yeni evreleme sisteminde arjirofilik NT/NFY I-VI evreleri öncesinde a-c evreleri beyin sapına sınırlı, 1a-1b evreleri ise ek olarak transentorhinal kortekste AT8-IR intranöronal inklüzyonların varlığına karşılık gelir. Ön-yumaklar daha onlu yaşlarda LC nöronlarının akson proksimallerinde görülmeye başlar (Evre a). Evre bde LC nöronları dendrit ve hücre gövdelerinde de AT8-IR inklüzyonlar saptanır. Dikkat çekici olan ön-yumaklar başlıca kortikal noradrenerjik projeksiyonun kökeni dorsal LCde görülürken spinal projeksiyonun kökeni olan ventral LCnin salim kalmasıdır. Evre cde ise ek olarak serotoninerjik dorsal raphe ve kolinerjik bazal önbeyin magnoselüler nöronları (Meynert çekirdeği) da tutulur. Evre 1ada a-c subkortikal tutulumuna ek olarak özellikle LC limbik projeksiyonlu nöronlarının transentorhinal kortekse ulaşan akson distalleri AT8-IR gösterir. Evre 1bde ise artık transentorhinal piramidal projeksiyon nöron dendrit ve gövdelerinde ön-yumaklar saptanır olur. Arjirofilik NT/NFY Evre I-IIde saptanır olduğunda buna daima önceki evreler 1b şeklinde eşlik eder. Birkaç 10 yıl sürebilen ön evreler boyunca beyinsapında nöron kaybı yoktur. Orta NT/NFY evrelerinden (III-IV) itibaren beyinsapında özellikle LCde NT/NFY saptanmaya, nöron kaybı ve hayalet yumaklar görülmeye başlar. Hayalet yumaklar baskın olarak veya tümüyle 3R tau özelliğindedir. LCde nöron kaybı kognitif bozukluk şiddetiyle korele eder.
NIA-AA AHnin Nöropatolojik Değerlendirmesi Yönergesi
NIA-AA 2011de değişen yeni AH Tanı Kriterleri ile uyumlu olacak bir yeni nöropatolojik kriterler için bir yıl sonra bu kez de Yönergeyi yayınladı. Bu Yönergede kısaca bir ABC skoru önerildi. A amiloid, B Braak ve C CERAD baş harflerinden türetilmişti.
NIA-AA ABC Skoru
A. Aβ plak skoru (Thal modifikasyonu):
A0 Aβ veya amiloid plakları yok
A1 Thal fazları 1 veya 2
A2 Thal fazı 3
A3 Thal fazları 4 veya 5
B. NFY evresi (Braak modifikasyonu):
B0 NFYler yok
B1 Braak evresi I veya II
B2 Braak evresi III veya IV
B3 Braak evresi V veya VI
C. Nöritik plak skoru (CERAD modifikasyonu):
C0 nöritik plak yok
C1 CERAD skoru seyrek
C2 CERAD skoru orta
C3 CERAD skoru sık
ABC skoru klinik öyküden bağımsız olarak bildirilir. Örneğin, Alzheimer Hastalığı Nöropatolojik Değişiklikleri: A1, B0, C0 veya Alzheimer Hastalığı Nöropatolojik Değişiklikleri: A3, B3, C3.
Doku temin edildiğinde kognitif bozukluğu olmayan bireylerde saptanan AH nöropatolojik değişikliği pre-klinik AHye karşılık gelir. Doku temin edildiğinde kognitif bozukluğu olan bireylerde saptanan Orta veya Yüksek düzey AH değişikliği kognitif bozukluğa karşılık gelen nöropatolojik değişiklikler olarak kabul edilmelidir. Kognitif bozukluk varlığında Düşük düzey AH nöropatolojik değişiklikleri saptanmışsa ko-morbid durumların mevcudiyeti muhtemeldir. Kognitif bozukluğu olan tüm olgularda AH nöropatolojik değişikliklerinin düzeyine bakılmaksızın ko-morbid durumların mevcut olup olmadığı saptanmalıdır (Tablo 5).
Tablo 5. Nöropatolojik Değişiklik Düzeyi.
|
A: Aβ/amiloid plak skoru (Thal fazları) |
C: Nöritik plak skoru (CERAD) |
B: NFY skoru (Braak evresi) |
||
|
B0 veya B1 (Yok veya I/II) |
B2 (III/IV) |
B3 (V/VI) |
||
|
A0 (0) |
C0 (yok) |
Değil |
Değil |
Değil |
|
A1 (1/2) |
C0 veya C1 (yok-seyrek) |
Düşük |
Düşük |
Düşük |
|
C2 veya C3 (orta-sık) |
Düşük |
Orta |
Orta |
|
|
A2 (3) |
C0-3 |
Düşük |
Orta |
Orta |
|
A3 (4/5) |
C0 veya C1 (yok-seyrek) |
Düşük |
Orta |
Orta |
|
C2 veya C3 (orta-sık) |
Düşük |
Orta |
Yüksek |
|
Nöron kaybı
AHde nöron kaybı ECxten başlar. Limbik sistemi terkettiğinde superior temporal sulkusta tespit edilebilir. Nöron kaybının zaman içinde ilerleme ve anatomik yatkınlık tarzı genel anlamda NFYnin tarzına benzese ve NFY ile nöron sayılarının arasında anlamlı negatif korelasyonlar saptansa da, nöron ölümünden tek başına NFYler sorumlu tutulamaz. Bunun nedenlerinden biri, yukarda değinildiği gibi, taunun sadece fosforillenmesinin nöron ölümü için yeterli olmaması, ayrıca asetillenmesinin de gerekmesi olabilir. Subkortikal çekirdekler gibi NFYlerin bulunduğu bölgelerde ille de nöron kaybının olması gerekmediği gibi, NFYlerin az sayıda olduğu ya da hiç bulunmadığı bölgelerde de ağır nöron kaybı görülebilir. Amiloid nörotoksisitesinin neden olduğu sinaps kaybı ve transsinaptik dejenerasyon hücre ölümünde rol oynayan bir diğer etmen olabilir.
Sinaps kaybı
Sinaps kaybı kortikal biyopsi örneklerinde klinik demans ağırlığıyla, nöron kaybından dahi daha kuvvetli korelasyon gösteren yapısal değişikliklerin başında gelir. Sinaptofizin gibi sinaptik proteinlerin miktarlarının da demans ağırlığıyla korele ettiği gösterilmiştir. Sinaps kaybı başlangıçta NFY ve nöron ölümünün anterograd Wallerian dejenerasyon sonucu sekonder etkisi ile açıklansa da, primer hasarın özellikle de intraselüler çözülebilir Aβ oligomeri aracılığıyla sinapslara olması ve bozukluğun retrograd olarak hücre gövdesine taşınarak, NFY oluşumu ve nihayetinde hücre ölümüne yol açması artık daha muhtemel görünmektedir.
Çözülebilir Aβ oligomerinin toksisitesi ve neden olduğu erken sinaptik disfonksiyon üzerine odaklanan çalışmalar çözülemez fibriler formun veya daha olgun plakların parenkimde oynadığı rol yerine toksik çözülebilir oligomerin veya ADDLın hücre yüzeyinde uygun bir reseptör bulup bağlandıktan sonra veya membrandan intraselüler mesafeye geçtikten sonra başlattığı bir dizi zincirleme reaksiyonun doğasını aydınlatmaya başlamıştır. Bu mekanizmaların basamaklarının aynı zamanda nedene yönelik tedavi hedefleri de oluşturmaları heyecan vericidir.
Bu çalışmaların ortaklaştığı bir nokta Aβ oligomerinin başlangıçta inhibitör GABA-erjik sinapsları salim bırakırken eksitatör glutamaterjik sinapslarda değişikliklere neden olması, buna bağlı olarak öğrenmenin temelini teşkil eden moleküler mekanizma olan uzun süreli potansiasyonu (LTP) baskılarken, uzun süreli depresyonu (LDP) teşvik etmesidir. Inestrosa grubu, oligomerin glutamaterjik eksitatör sinapslarda NMDA reseptörü stabilitesini sağlayan neurogilin 1 ile etkileşirken GABA-erjik inhibitör sinapslardaki neurogilin 2 ile etkileşmediğini gösterdiler. Aynı araştırıcılar bu etkileşimin embriyogenez gibi bir dizi diğer işlevleri yanısıra akson rehberliğinden sorumlu Wnt sinyalizasyonunu bozduğu ve AHde bu sinyalizasyonun son ürünü olan nükleer transkripsiyon faktörü β-katenin miktarlarının azaldığını buldular. Bu etkileşim, sonunda NMDA ve AMPA reseptörlerinin postsinaptik membrandan endositozla kaybına yol açar. Reseptörlerin kaybıyla sinaps atrofiye uğrar. Wnt sinyalizasyonunu aktive eden ligandlar Aβnın tetiklediği sinaptik değişiklikleri geri çevirebilmektedir. Wnt sinyalizasyonu sinaptik öz-savunma mekanizmalarından biridir. AH için de başlıca risk faktörü olan bu sinaptik öz-savunma mekanizmaları yaşlanmayla birlikte zayıflamaya başlarlar. Şekil 9ada Aβnın neden olduğu glutamaterjik sinaptik disfonksiyon ve Wnt sinyalizasyonu şematik olarak gösterilmiştir. Bu sinyalizasyon mekanizmalarından bir diğeri de sirtuin sinyalizasyonudur. Sirtuinler proteinlerin asetil grubunu kaldıran (deasetilaz) ve ADP-riboziltransferaz işlevleri gören bir uzun ömür faktörüdür. SIRT1 ve SIRT2 isimli sirtuinlerin DNA onarımında rol aldığı, aktivitelerinin yaşlanmayla birlikte zayıfladığı gösterilmiştir. Aβ oligomerleri SIRT1 aktivitesini bozarken, tersine kırmızı şarapta da bulunan bir polifenol olan resveratrol gibi maddelerle SIRT1 geninin aktivasyonu mümkün olmaktadır. Ayrıca bir sitokin proteini olan fraktalkinin (CX3CL1) aktivitesinin arttırılması da AHde azalan SIRT1 aktivitesini arttırmakta ve böylelikle aktive olmuş NF-κB sinyalizasyonu inhibe edilerek tetiklenen enflamatuvar süreç tersine çevrilebilmektedir. NF-κB sinyalizasyonu üzerinden enflamatuvar değişikliklere aşağıdaki ilgili bölümde daha ayrıntıyla değinilecektir. Serebral insülin sinyallemesi ve Aβ oligomerinin hücre yüzeyine bağlandıktan sonra tetiklediği mekanizmalar da birbirinin tam tersi gibi görünüyor.
Serebral insülin sinyallemesi sinaptik enerji homeostazından sorumludur. Nöronlarda bir tirozin kinaz reseptörü gibi işlev gören insülin reseptörlerine (IR) bağlanan insülin fosfatidilinositol-3-kinaz (PI3K) üzerinden nihayetinde protein kinaz Cyi aktive ederek aşağıda kolinerjik kayıp bölümünde daha ayrıntıyla söz edilen ve Şekil 9bde şematik olarak gösterilen anti-AH mekanizmaları tetikler. AH hastalarının bir bölümü yüksek açlık insülin düzeylerine sahiptir (periferik direnç). FDG-PET ile de gösterilen nöronal glukoz kullanımı bozukluğu (hipometabolizma) AHde göreli erken bir özelliktir ve kognitif bozukluk şiddetiyle korele eder. AHli hastaların bir bölümünde nöronal IRler, glukoz taşıyıcı proteinler ve diğer insülin yolağı ilintili bileşenler azalır (santral direnç). Aβ dendritik IRleri azaltırken insülin, oligomerin tetiklediği LTP baskılanması ve sinaptik kaybı tersine çevirir. Bu bulgular insülin sinyallemesini etkileyen ajanları AHnin potansiyel terapötik ajanları durumuna getirmiştir.
Aβnın LTP depresyonu yapacak şekilde NMDA reseptörlerine bağlanması ve nihayet önce glutamaterjik NMDA sonra da glutamaterjik AMPA reseptörlerinin endositozla kaybolması bilinmekle birlikte bunun doğrudan Aβnın reseptöre bağlanmasıyla değil fakat bilinmeyen bir transmembran proteine bağlanıp bir kompleks oluşturduktan sonra gerçekleştiği ileri sürülmekteydi. Yakın tarihte bu bilinmeyen transmembran proteinin prion proteini (PrPc) olduğu ileri sürüldü. Araştırıcılar Aβnın 350 transmembran protein arasından baskın olarak PrPcye bağlandığını gösterdiler. İlk bakışta bu durum şaşırtıcı çünkü bu proteinin proteolitik kesimi ve sonrasında hatalı katlanarak fiziksel konformasyonunu değiştirmesi (PrPSc) ve birikmesi bir başka nörodejeneratif hastalıklar grubuna, yani içlerinde Creutzfeldt-Jakob hastalığının da bulunduğu prion hastalıklarına yol açmaktadır. PrPcye AH patogenezinde atfedilen bu temel rol doğrulandığı takdirde 2 büyük nörodejeneratif hastalığın aydınlatılmasında önemli bir dönüm noktası olabilir. Araştırıcıların çalışmaları oldukça ikna edici görünmektedir. PrP nakavt transjenik farelerde Aβ ile LTP supresyonu gerçekleşmemektedir. Son derece virulan bir transjenik model olan APP/PSEN mutantların PrP nakavtlarla çaprazlanan soyunda sağkalım artıyor, APP/PSEN Tglerdeki tipik pasif kaçınma öğrenme bozuklukları görünmüyor ve mekansal öğrenmeleri doğal tip farelere benzer düzeyde normal oluyor. Buna karşılık Aβ-PrPc kompleksi NMDA reseptörlerinin tipik endositozuna yol açtıkları gibi bu farelerde dendritik diken kaybı, nöritik distrofi ve sonunda hücre kaybı gibi AHnin diğer tipik sinaptik patolojisinin tümü görülüyor. Son olarak, intraselüler Aβnın mitokondriyal stabiliteyi de bozup apoptozu tetikleyecek reaktif oksijen türlerinin (ROS) oluşumuna neden olduğu bilinmektedir. AHli beyinlerde mitokondriyal membran stabilitesinden sorumlu füzyon proteinleri dynaminlerin ve bunların arasında özellikle de DLP1in düzeyi düşmekte, bunun sonucunda intraselüler mitokondri dağılımı bozulmakta, sayıları azalmakta ve bu durum sonunda dentritik diken sayısını azaltıp sinaps kaybına yol açmaktadır. Tersine, deneysel modellerde DLP1 aşırı ifadesi ADDL ile tetiklenen mitokondriyal değişiklikleri tersine çevirmektedir.
Gliozis ve Enflamasyon
Gliozis AH nöropatolojisinin bir başka özelliğidir. Aβnın nöritik plaklarda birikiminin mikroglial ve astroglial hücreleri aktive ettiği AH patogenezinde göreli geç bir olay olarak öteden beri iyi bilinmektedir. Mikroglial aktivasyon sitokinlerin salgılanması, akut faz reaktanları ve komplemanın aktive edilmesiyle enflamasyonu harekete geçirir. Son zamanlarda plaklardan bağımsız olarak doğrudan Aβ oligomerinin ileri glikasyon son ürünleri reseptörü (RAGE) ile bağlanarak MSSdeki başlıca pro-enflamatuvar sinyalleme sistemi olan aktive B hücrelerinin kappa hafif zincir güçlendiricisi nükleer faktörünü (NF-κB) tetiklemesinin AHde erken bir fenomen olarak enflamasyona yol açtığının üzerinde durulmaktadır.
NF-κB enfeksiyona immun cevapta DNA transkripsiyonunu düzenleyen bir protein kompleksidir. Sinaptik plastisite ve bellek işlevlerinde de rolü gösterilmiştir. Kanser, çeşitli enflamatuvar ve otoimmun hastalıklar ve AHde NF-κB sinyallemesi yolundan sapar. RAGE immunoglobulin süper familyasına dahil bir transmembran reseptör proteindir. İleri glikasyon son ürünleri (AGEler) yaşlanma yanısıra diyabetik hiperglisemi gibi patolojik durumlarda glikozillenme ile başlayan bir dizi kimyasal reaksiyonun nihai ürünleri olan ligandlardır. RAGEin, AGEler yanısıra Aβ, HMGB1, s100, Mac-1 gibi bir dizi başka ligandı bağlayarak diyabet komplikasyonlarıyla birlikte, AH, multipl skleroz, inme gibi nörolojik hastalıklar, romatoid artrit, ateroskleroz, koroner kalp hastalığı gibi sistemik hastalıklarda rol oynadığı bulunmuştur. Tam uzunlukta RAGE (flRAGE) bir transmembran protein iken alternatif düğümlenme ile üretilen şekli olan endojen sekretuar RAGE (esRAGE) ve RAGEin proteoliziyle ortaya çıkan enzimatik kesilmiş RAGE (ecRAGE) RAGEin çözünür biçimleridir (sRAGE). sRAGE de flRAGE gibi ligand bağlar, ancak hücre yüzeyine bağlı olmadığı için NF-κB gibi sinyalizasyon tetiklenmesine neden olmadığı gibi flRAGEe bağlanarak pro-enflamatuvar zinciri başlatacak olan ligandları kendine bağlayarak bir tampon işlevi görür. Yaşlanma süreci gibi AHnin de flRAGE düzeylerinin artıp sRAGE düzeylerinin düştüğü süreçler olduğu düşünülebilir. sRAGE aynı zamanda sirkülasyonda bulunur ve artmış düzeyleri daha fazla Aβnın LRP1 aracılığıyla kan-beyin bariyerinden dolaşıma aktarıldığı bir küvet (sink) etkisiyle Aβnın klirensine karşılık gelir. NF-κB sinyalizasyonunun Aβ-RAGE etkileşimi ile tetiklenmesinin yanısıra, yukarda değinildiği gibi Aβnın yol açtığı SIRT1 inaktivasyonu da devreye giren NF-κB sinyalizasyonunun üzerindeki denetimi kaldırarak bir pozitif geribildirim etkisi yapmaktadır. RAGE etkileri Şekil 9a ve 9bde şematik olarak gösterilmiştir. Enflamasyonun, serbest radikallerin ortaya çıkışı, oksidatif gerilim, kalsiyum homeostazı ve mitokondriyal membranda bozulmalar ile birlikte gittiği düşünülmektedir. Astrositler butiril kolin esteraz (BChE) gibi normalde aktivitesi ihmal edilecek düzeyde olan bir dizi molekülün de kaynağıdır ve dolayıyla da gliozis asetil kolinin parçalanmasında da alternatif yolu devreye sokmaktadır.
Mesulam ve çalışma arkadaşları asetilkolinesteraz (AChE) histokimyası ve kolin asetil transferaz (ChAT) immünhistokimyası kullanarak bazal önbeyindeki ChAT-immünopozitif nöronları sınıflamak üzere morfoloji ve rostro-kaudal organizasyona dayanan Ch sektörel terminolojisini önererek dört sektör ayırt ettiler: Ch1-4. Ch1, mediyal septal nukleus (MSN) ve Ch2, Brocanın diagonal bandının vertikal bacak nukleusu (nvlDBB) hippokampusun kolinerjik aferentlerini sağlar. Ch3, Brocanın diagonal bandının horizontal bacak nukleusu (nhlDBB) bulbus olfactoriusun kolinerjik afferentidir. Bütün korteksin ve amigdalanın kolinerjik innervasyonu ise Ch4 veya Meynert çekirdeğinden (Meynertin bazal çekirdeği - nbM) sağlanır. Bu innervasyon dikkat ve bellek işlevlerinin optimal sürdürülebilmesi açısından büyük önem taşır. Yukarda değinildiği gibi tau hiperfosforilasyonun ilk görüldüğü alanlardan biri de Meynert çekirdeğidir (Braak Evre c). AHde limbik alanlardaki yaygın NFY formasyonu ve nöron kaybı Meynert çekirdeğini de etkiler. Kolinerjik aksonların kaybı diğer patolojik özellikler gibi bir bölgesel yatkınlık gösterir. Lokal internöronlardan sağlanan striatal kolinerjik innervasyon ve talamusun beyinsapı pedinkülopontin çekirdek kaynaklı kolinerjik innervasyonu etkilenmediği gibi, etkilenen Meynert kaynaklı kolinerjik innervasyon da aynı tarzı yansıtır: kortekste en fazla etkilenen bölgeler limbik ve asosiasyon korteksleri iken, primer sensoryal ve motor korteksler göreli olarak salim kalırlar.
Kolinerjik buton da denilen pre-sinaptik kolinerjik terminalde ChAT bir yandan mitokondrilerden asetil koenzim A aracılığı ile serbestlenen kolinden, diğer yandan da yüksek afiniteli kolin geri alınım sistemi aracılığıyla alınan kolinden asetil kolin (ACh) üretir. ACh molekülleri veziküllere paketlenip depolarizasyonu izleyerek sinaptik aralığa salgılanır. Sinaptik aralıkta difüzyonla ilerleyen ACh post-sinaptik membranda nikotinik reseptörlere bağlanarak doğrudan, muskarinik reseptörlere bağlanarak ise G-proteini ilişkili ikincil mesajcılar üzerinden etkisini gösterir. Nikotinik etkilerin hücrenin uyarılabilirliğini arttırarak dikkat tonusunun sağlanmasında rol oynadığı, muskarinik etkilerin ise kalıcı sinaptik değişikliklerle yeni bilginin depolanması şeklindeki nöroplastisite mekanizmalarının unsuru olduğu bilinmektedir. Beyinde α7 nikotinik reseptörler (α7nAChR) pre-sinaptik yerleşimlidir ve uyarılmaları AChnin pre-sinaptik akson terminalinden salınımını arttırırken, yine pre-sinaptik muskarinik 2 ACh reseptörleri (M2AChR) tam tersine ACh salınımı inhibe ederler. AHnin erken döneminde α7nAChRde kompansatuar bir artış söz konusuyken pre-sinaptik denge giderek nikotinik aleyhine ve muskarinik lehine dönmeye başlar. Post-sinaptik membranda bulunan ve her ikisi de AH sürecinde erken dönemde kaybolmaya başlayan M1AChR ve hem pre- hem de post-sinaptik yerleşmiş olan α4β2nAChRlerin uyarılması yukarda değinilen hızlı (nikotinik) ve yavaş (muskarinik) kolinerjik nörotransmisyona aracılık eder. Hem nikotinik, hem de muskarinik stimülasyon kaybının gerek α-sekretaz etkinliğinin azalmasıyla Aβ oluşumunun artması ve gerekse de GSK-3β etkinliğinin artmasıyla taunun patolojik fosforilizasyonunun da artması şeklinde in vitro etkileri gösterilmiş, diğer yandan Aβnın α7nAChR blokajı üzerinden AChnın sentez, salınım ve post-sinaptik etkinliğini azaltabileceği de ortaya konmuştur. Bu durum Aβ ve kolinerjik kaybın birbirlerini pozitif geri besledikleri bir kısır döngü oluşturmaktadır. Muskarinik kolinerjik nörotransmisyonun tetiklediği fosfoinositol sistemi üzerinden anti-Alzheimer mekanizmalar Şekil 8 ve 9da gösterilmiştir. Bu mekanizmalar α4β2 ve α7 nikotinik ile M1 muskarinik agonizmanın bir tedavi hedefi olarak önemini göstermektedir. M2 antagonizmasının hayvan modellerinde M1 agonizmasına benzer anti-AH etkileri gösterilmiştir. Asetilkolinesteraz (AChE) enzimi katalitik iyonik kısmının aktivitesiyle AChyi asetat ve koline hidrolize ederek AChnin post-sinaptik aktivitesini durdurur. AChEnin diğer yandan periferik aniyonik kısmı aracılığıyla Aβ oligomerleriyle oluşturdukları fibriler kompleksin de tek başına oligomerinkini aşan toksik etkileri gösterilmiştir. AChE inhibitörleri AH tedavisinin ilk yerleşik ajanları olarak terapötik cephanede çoktan yerlerini almışlardır.
Şekil 8. Kolinerjik sinaps. Pre-sinaptik akson terminalinde ChAT, asetil CoA aracılığıyla kolini asetilleyerek ACh oluşturur. ACh veziküller içine paketlenerek sinaps aralığına salınır. Presinaptik nikotinik α7 reseptörlerinin uyarılması ACh salınımını stimüle ederken (yeşil ok), muskarinik M2 reseptörlerinin uyarılması inhibe eder (kırmızı çubuk). Sinaptik aralığa salınan ACh post-sinaptik nikotinik α4β2 reseptörleriyle bağlandığında Na+ kanalı açılır ve içeriye Na+ girerek dikkatten sorumlu hızlı kolinerjik nörotransmisyonu başlatır. Muskarinik M1 reseptörlerine bağlanan ACh, reseptöre bağlı Gq proteinini aktive ederek PLCyi fosforiller. Fosforile PLC bir yandan ikincil mesajcılardan membrana bağlı diasil gliserolü (DAG) aktive ederek PKCyi doğrudan fosforillerken, diğer yandan da fosfoinositol difosfattan (PIP2) inositol trifosfat (IP3) üreterek endoplazmik retikulumdaki (ER) kendi reseptörüne bağlanacak diğer ikincil mesajcıyı hücre içine salar. IP3, ERden Ca++salınımını sağlar ve artan intraselüler Ca++ böylece daha fazla PKCyi dolaylı yoldan fosforillemiş olur. Fosforile PKC, mitojen aktive protein kinaz (MAPK) aracılığıyla nükleer transkripsiyonu devreye sokar ve öğrenmenin temeli olan yeni sinaps yapımına aracılık eder. Sinaps aralığında işlevi biten ACh, AChE aracılığıyla asetat ve koline parçalanır. Kolin pre-sinaptik terminalden kolin taşıyıcısı aracığıyla geri alınır.
Şekil 9. AHli sinapsta Aβnın anti-glutamaterjik ve anti-plastisite etkileri.
Şekil 9a. Glutamaterjik sinaps, GABA-erjik olanın tersine AHde erken dönemde saldırı altındadır. APPnin amiloidojenik proteolizi sonrası ortamdan temizlenemeyen çözünür Aβ oligomeri post-sinaptik membranda bir dizi patolojik zinciri tetikler. Bunların sonucunda, önce NMDA, sonra da AMPA olmak üzere glutamaterjik (GluR) sinapslar endositozla kaybedilir. Sonuçta glutamaterjik aktiviteye dayanan ve öğrenmenin moleküler mekanizması olan uzun süreli potansiasyon (LTP) giderek azalırken, uzun süreli depresyon (LTD) artar. Bu etkinin GluR ile doğrudan etkileşimle değil fakat başka bir transmembran protein (TMP) olan bir aracı üstünden olduğuna dair deliller mevcuttur. Bu aracılardan biri olarak normal TMP prion proteini (PrPc) gösterilmiştir. Diğeri ise yalnızca glutamaterjik sinapslarda bulunan ve GluR stabilitesini sağlayan neuroglin 1dir. Neuroglin 1-Aβ kompleksinin Wnt sinyalizasyonunu başlatacak ligandın reseptörüne bağlanmasını engellediği, bunun sonucunda da GSK3β-Axin-APCden oluşan yıkım kompleksinin inhibe edilemeyerek bir nükleer transkripsiyon faktörü olan β-kateninin işlevini göremeden yıkıldığı bilinmektedir. Çözünür Aβ oligomeri ileri glikasyon son ürünleri reseptörü (RAGE) ile de etkleşir. Nöronal membranda etkileşim temel enflamatuvar sinyalizasyon olan NFκB sinyalizasyonunu tetikler ve böylelikle ortama enflamatuvar sitokinler salınır. Aβ fagositozu için aktive olmuş mikroglia da RAGE-Aβ etkileşimi ile salınan enflamatuvar sitokinlerin bir diğer kaynağıdır. Bir TMP olan RAGE, bu tür proteinlerin proteolizinden sorumlu olan bir metalloproteinaz olan ADAM10 aracılığıyla kesilerek parenkime salınan çözünür RAGE (sRAGE) oluşur. sRAGE de Aβ bağlar, ancak artık membrana bağlı olmadığından bir patolojik zinciri başlatmanın tam tersine Aβyı nötralize eden bir işlev görür. Aβ düşük yoğunluklu lipoprotein reseptörü 1 (LRP1) aracılığıyla kan-beyin bariyerinden dolaşıma verilir. Vasküler endotel membranındaki RAGE Aβyı yeniden beyne alırken, dolaşımdaki sRAGE Aβ bağlayarak buna karşıt çalışır. Dolayısıyla, RAGE antagonistleri ve sRAGE agonistlerinin potansiyel anti-AH farmakolojik stratejiler olduğu söylenebilir. Yerleşik tedavi stratejilerinden biri olan memantinin bilinen etki mekanizması NMDArda Mg++ tıkacı işlevi görerek mevcut Ca++ sızıntısı kaynaklarından birini engellemek iken hücre içinde de hiperfosforile tauyu parçalayacak fosfataz agonizması yaptığına dair de deliller vardır.
Şekil 9b. Kolinerjik sinaps da AHde erken tehdit altiındadır. Çözünür Aβ oligomerleri pre-sinaptik membranda asetil kolin (ACh) salınımını inhibe eden M2 muskarinik reseptörlere değil de, tam tersine salınımı arttıran α7 ve α4β2 nikotinik reseptörlere bağlanarak kolinerjik nörotransmisyonu azaltırlar. M2 antagonizması ve/veya α7 ve α4β2 agonizması yapan ajanlar bu dengeyi tersine çevirebilirler. Post-sinaptik M1 kolinerjik aktivite gibi insulin sinyalizasyonu da protein kinaz C (PKC) fosforillenmesi üzerinden anti-AH etkiler (ADAM17 aktivasyonu, β-sekretaz ve GSK3β inhibisyonu) gösterir. Dolayısıyla, M1 agonistleri ve insulin potansiyel anti-AH etkilere sahiptirler. Asetil kolin esterazın (AChE) periferik kısmına bağlanan Aβ ile oluşturduğu kompleksin oligomerin toksisite aracılarından biri olduğu gösterilmiştir. Dolayısıyla, katalitik kısma bağlanan klasik inhibitörlerden farklı olarak ayrıca periferik kısmı da bloke edecek dual inhibitörler daha güçlü bir anti-AH etki gösterebilirler. DNA onarımıyla görevli sirtuin sinyalizasyonunun Aβ ile tam tersi etkilere sahip olduğu bilinmektedir. İntraselüler Aβ sirtuin sinyalizasyonunda rol oynayan başlıca moleküllerden biri olan SIRT1i inhibe ederken, bir TMP olan fraktalcinenin (CX3CL1), örneğin kırmızı şarapta da bulunan bir polifenol olan resveratrol ile uyarılması CX3CL1in, aynı zamanda APPnin non-amiloidojenik proteolizini sağlayan ADAM17yi aktive etmesini sağlamakta, bunun sonucunda aktive olan SIRT1 ise RAGEi kesecek ADAM10u aktive ederek pro-enflamatuvar NFκB sinyalizasyonunu durdururken, diğer yandan da pro-plastisite nükleer transkripsiyon faktörlerini harekete geçirmektedir.
Diğer nörotransmitter kayıpları
Noradrenerjik kayıp
Yukarda değinildiği gibi ön-yumaklar AH ilintili nöropatolojik değişiklik olarak kabul edildiği takdirde beyinsapındaki noradrenerjik (NA-erjik) çekirdek olan LC intranöronal birikintileri AHdeki iki yaygın ön kabulün de değişmesini gerektirecek özelliktedir: 1. AHde progresif amiloidoz kronolojik olarak AH-Pnin ilk nöropatolojik fenomenidir; 2. AHde tau patolojisi entorhinal kortekste başlar, patolojik tau fosforilasyonu ilk olarak nöroplastisite potansiyeli en yüksek olan limbik sistemde görülür. Beyinsapında ön-yumaklar gerek en erken amiloidoz delilleri ve gerekse de ilk NFYlerin transentorhinal kortekste görülmesinden dekadlar önce özellikle de LCde görülmektedir (Braak Evre a ve b). Ancak LCde ön-yumakların görülmesi ile ilk nöron kaybının görülmesi arasında da dekadlar süren bir zaman aralığı olduğu anlaşılmaktadır. Bu sırada NFY yayılımı da orta evrelere (Braak Evre III-IV) ulaşmış ve NFYler beyinsapında da görülür olmuştur. Bu bulgular ön-yumakların hücre ölümüne ve belki de NA-erjik disfonksiyona neden olmadığı, hücre ölümünden kortekste olduğu gibi beyinsapı NFYlerinin sorumlu olduğunu düşündürmektedir. LCdeki ön-yumaklar seçici yatkınlığa uygun biçimde LCnin kortikal projeksiyonları olan anteriyor ve mediyal bölümlerini tutarlarken spinal ve serebellar projeksiyonları içeren kaudal ve lateral bölümleri salim kalır. İyi bilinen NA-erjik işlevler olan dikkat, gerilim cevapları ve uyanıklık yanısıra NA MSSde glial β-adrenerjik reseptörler aracılığıyla anti-enflamatuvar etkiler de gösterir. Bu etki mikroglial aktivasyonla Aβ klirensinde çok önemli rol oynar. LC nöronları NA yanısıra bir nörotrofik faktör olan BDNF de salgılarlar. BDNF fonksiyonu hiperfosforile tau toksisitesine karşı bir direnç faktörü olarak da düşünülebilir. Nöropatolojik çalışmalarda gösterilen LCde nöronal kayıp ile kognitif kayıp arasındaki korelasyon, LC için özel geliştirilmiş ve LC nöronal kaybına duyarlı görüntüleme teknikleri ile (LC-I) yaşayan hastalarda da tekrarlanmıştır.
Serotoninerjik kayıp
AHde serotoninerjik (5-HT-erjik) dorsal raphe çekirdeği ön yumakların, yukarda değinildiği gibi, LCden sonra en erken görüldüğü beyinsapı yapısıdır (Braak Evre c). LCye benzer şekilde dekadlar sonra burda da NFYler görülür ve belki LCde olduğu kadar olmasa da nöron kaybına neden olur. Kortikal 5-HT-erjik akson terminallerinde 5-HTnin salınımı ve geri alınımı ciddi düzeyde bozulmuştur. AHde 5-HT-erjik kayıpla depresyon ve saldırgan davranışın korelasyonu bildirilmektedir. 5-HT geri alınım blokerlerinin (SSRI) AHdeki depresyon ve ajitasyonun tedavisindeki rasyoneli bu gözlemlere dayanmaktadır.
Dorsal raphede bildirilen bu kayıp ve pre-sinaptik serotonerjik aktivitedeki bu eksikliklere rağmen AHde serotonerjik sistemin hiperaktif olabileceğine dair görüşler mevcuttur. Bu sağduyuya karşıt gibi görünen durumun nedeni farklı post-sinaptik 5-HT reseptörlerinin işlevsel farklılıkları ve yerleşimleri ile ilintilidir. Bunlar arasında 5-HT1a ve 5-HT6 reseptörler siklik AMPnin intraselüler düzeylerini azaltarak ve dolayısıyla plastisite karşıtı bir mekanizmayla işlev görürler. Her iki reseptör tipi de limbik sistemde zengin bulunur. 5-HT6 özellikle glutamaterjik ve kolinerjik nöronları doğrudan inhibe edecek pozisyonda bulunan GABA-erjik nöronlarda zengindir.
Spesifik 5-HT antagonizması aracılığıyla cAMP intraselüler düzeylerinin azaltılmasına karşı durmanın pro-plastisite etkilerinin gösterilmesinden sonra cAMPyı yıkan enzim olan fosfodiesterazın (PDE) inhibisyonunun terapötik poyansiyeli üzerinde durulmuştur.
Dopaminerjik kayıp
AH ileri evrelerinde parkinsonizm sıradışı bir olgu değildir. Bu olguların patolojik karşılığı büyük sıklıkla substantia nigra pars compacta (SNc) dopaminerjik (DA-erjik) nöronlarında kayıp ve Lewy cisimcikleridir (LC). LCD kendine özgü bir antite olarak ortaya çıkmışken LCD ve AHnin içiçe geçtiği durumlar olan hem NFY-AP hem de kortikal Lewy cisimciklerinin sonucu olan klinik durumların LCD mi yoksa AHnin Lewy varyantı (AH-LV) olarak mı adlandırılacağı tartışmalıdır. LCler ve NFY-AP birlikteliği için 2 ayrı nöropatolojik örüntü sınıflandırmaya yardımcı olabilir. LCler gerek sporadik ve gerekse de ailesel AHde en sık amigdalada ve %60a yaklaşan bir oranda görülürler. Diğer limbik alanlar, özellikle de periamigdaloid ve entorhinal korteks amigdaladan sonra en sık görüldükleri yerlerdir. LCDye özgü neokortikal ve beyinsapı yerleşimi çok daha seyrektir. Buna karşılık LCDde yaygın neokortikal ve beyinsapı yerleşimine değişken miktarlarda AH tipi patoloji eşlik edebilir.
Alzheimer Hastalığının Nedenselliği Üzerine Son Değerlendirmeler
AH araştırmacıları plaklar ve yumaklar temelinde, hangisinin birincil rolü oynadığı üzerine nerdeyse uzlaşmaz iki kampa büyük ölçüde ayrılmış durumdadırlar. Bu kamplaşmanın dinsel fanatizme benzerliğine ince bir eleştiriyle de, tau patolojisini (yumakları) ön plana alanlara Tauistler, β-amiloid patolojisini alanlara ise Baptistler dendiği olmuştur.
Gerçekten de, ancak demans evresinde tanınabilen hastalığın klinik evreleri NFY yayılımıyla çok iyi korele ederken, AP ile korelasyonun olmaması Tauistlerin temel tezi olurken, gösterilen bütün genetik bozuklukların Aβ (veya Beta-amiloid protein: Bap) üzerinden etkisini göstermesi, buna karşılık tau mutasyonlarının AH dışı dejenerasyonlara neden olması Baptistlerce tezlerinin kanıtı gibi sunulmuştur.
Günümüzde ilk bakışta Baptizm tartışmasız bir zafer kazanmış görünmekte ve amiloidin hastalığın tetikçisi olduğu, buna karşılık tau patolojisinin bir epifenomen olduğu artık egemen görüş olarak yerleşmiş durumdadır. Tetikçi amiloid olduğuna göre bunun doğal sonucu olarak neredeyse tüm nedene yönelik tedavi çabaları anti-amiloid stratejilere vakfedilmiş durumdadır. Bu çabanın temel rasyoneli, tetikçi ortadan kaldırıldığı takdirde ona sekonder olarak gelişen fizyopatolojik değişiklikler, tau da dahil olmak üzere düzelecektir şeklinde özetlenebilir. Yeni yüzyılın ilk onyılında bu çabaların yarattığı büyük heyecan ve iyimserlik, klinik çalışmalarda nihai gelişim aşamasına kadar gelen hiçbir anti-amiloid aday molekülün ipi göğüsleyememesiyle, büyük maddi ve moral kayıplarla birlikte birbiri ardına hayal kırıklıklarına dönüşmüştür.
Bunlar arasında özellikle de Aβ antijeniyle ilk aktif immunizasyon çalışması olan ve katılımcılar arasında gelişen meningoansefalit olguları nedeniyle durdurulan AN1792 çalışması temel varsayımın sınanması açısından öğretici olmuştur. Katılımcılar arasından ölen olguların otopsilerinde serebral plak yükünde (hem gevşek, hem de sert plaklar) kayda değer bir azalmaya karşın NFY yükünde bir farklılık izlenmemiştir. Dahası, bu çalışmaya katılıp da yeterli antikor geliştiren hastaların uzun süreli izlemleri de dahil olmak üzere, çok sayıda farklı anti-amiloid tedavi çalışmalarına katılan hiçbir hasta grubunda bildirilen yararlanmanın büyüklüğü amiloid hipotezinden yola çıkarak beklenileceği gibi dramatik olmamış, plaseboya karşı farklı sonlanım ölçütleri açısından ancak marjinal yararlar ifade edilmiştir. İlk onyılın sonunda bu durum en militan Baptistler arasında dahi orijinal görüşe yönelik bir skeptisizmle birlikte görüşün revizyonu taleplerinin ileri sürülmesine neden olmuştur.
Daha önce gözden geçirildiği gibi demans AHnin oldukça ileri bir evresine karşılık gelmektedir ve bu ileri evrede amiloidle başa çıkmak yeterli olmamaktadır. Alzheimerli beyin, orduların sürekli yeniden mevzilendiği bir savaş alanı gibi düşünülebilir. Demans aşaması bu savaşın artık büyük ölçüde kaybedildiği bir evreye karşılık gelmektedir. Öyle görünüyor ki bu savaşın başlangıcında savunmanın henüz başarılı olduğu dönemde kolay degrade edilebilen Aβ40ın güvenlik kuvvetleri olarak düşünülebilecek şaperon moleküller, NA-erjik mikroglial aktivasyon aracılığıyla klirensini sağlamak ve BDNF gibi nörotrofik faktörlerle nöronların sağkalım dirençlerini arttırmak, kolay başa çıkılamayan daha saldırgan Aβ42yi ise gevşek plaklarda hapsetmek, ön-plakları onyıllar boyunca fazlaca zarar görmeden hücre içinde tutabilmek temel savunma stratejisidir. Böylesi bir çatışmanın henüz hiçbir kognitif yakınması olmayan bir yaşlının (hatta orta yaşlının) beyninde sürmekte olduğu ileri sürülebilir (AHnin pre-klinik evresi). İlk savunma mevzilerinin düşmeye başlamasıyla saldırganın Aβ (3(pE)-42 gibi daha elit birlikleri hücre içine girip sinapsları yok etmeye başlayacak ve bu kez savunma bunları, yıkılmış sinaps artıklarını da içeren, daha maliyetli ekstraselüler nöritik plaklara, intraselüler agrezomlara hapsetmeye çalışacaktır. Bu aşamada savunma da insülin, sirtuin, WnT, sRAGE gibi kendi elit birliklerini devreye sokarak saldırıya göğüs germeye çalışacaktır. İlk savunmanın böylesi çökmesinin karşılığı AHnin SCI aşaması olarak düşünülebilir (Braak Evre 1a-1b ve I/II). Bu ikinci savunma mevzisi de çökecek olursa bu kez tau da saldırganın 2. elit birliği olarak devreye girecek ve en başarılı olduğu savaş alanı olan limbik sistemden başlayarak nöronları öldürmeye başlayacaktır. Bu üçüncü aşama AHnin demans evresidir ve tau yeni mevziler kazanıp yayıldıkça savunma da giderek şiddetlenen demans maliyetini ödemek pahasına, sonuna kadar direnebileceği en tahkim edilmiş bölgeleri olan primer sensori-motor alanlara doğru geri çekilecektir. Bu senaryoya göre bir tetikçi tanımlamak gerekiyorsa bu Aβ değil fakat nöronun başlıca katili olan taudur gibi durmaktadır. Aβyı ise tetikçiyi tutan sponsor olarak düşünebiliriz. Öyleyse, AHden korunmanın yolu sponsorun tetikçiyi bulmasına engel olmak gibi durmaktadır. Dolayısıyla, hastalığı demans öncesi aşamasında, hatta pre-klinik döneminde tanımak artık bir zorunluluk olmuştur. Öyle görünüyor ki AHnin bu demans öncesi evreleri yeterli duyarlılık ve özgüllükte belirlenip tanındıktan sonra çeşitli anti-amiloid stratejileri bu erken aşamalarda denemek, bu ilk savunma kaybedildiğinde veya zaten hastalık gecikmiş demans aşamasında tanındığında bu kez başlıca anti-tau stratejilere yönelmek gerekecektir. Önümüzdeki onyılın genetik ve çevresel olarak AH riski taşıyan kognitif olarak normal yaşlı ve SCIlı bireylerin ve gerçekte prodromal AH olan MCIlı bireylerin biyo-işaretleyici kombinezonlarıyla hassasiyetle ayırtedilip, AH-P olanların anti-amiloid, AH-K olanların anti-tau tedavi klinik çalışmalarına dahil edileceği bir dönem olacağını ileri sürmek bir kehanet olmayacaktır.
Mesulam, AHnin nedenselliği için Baptizm ve Tauizm dışında kalan ve hastalığın yaşlılık riskiyle NT/NFY nöroanatomik yatkınlık tarzını gayet iyi açıklayan Nöroplastisite Yetmezliği Teorisini ileri sürmüştür. Bu hipoteze göre AH özetle, genetik ve çevresel etkilerle yaşam boyunca artarak biriken plastisite yükünün artık kaldırılamaz olması ile normal yaşlanmadan sapmanın sonuçlarıdır.
Nöroplastisite, MSSnin gelişim, yeni yaşantılama ve doku hasarına karşı verdiği yapısal tepkileri içerir. Nöronun post-mitotik bir hücre olması dolayısıyla, büyük ölçüde hücre yenilenmesi özelliği olmayan MSSde ontogenezin intra-uterin ve doğum sonrası ergenlik boyunca da sürecek dönemlerinde büyük bir nöroplastisite dinamizmi görülür.
Genetik olarak belirlenen ve sınırlanan bir çerçevede, daha intra-uterin dönemden başlayarak çevresel uyaranların modülatuar etkisi altında nöral gelişimin temel mekanizmaları olan nörogenez, nöral migrasyon, nöral eliminasyon ve stabilizasyon, sinaptogenez ve aksonal miyelinizasyon ilerleyici bir şekilde tamamlanır. Erişkin MSSye ait mimari tamamlanmadan önce, nöroplastisitenin nerdeyse sınırsız potansiyeli ile genetik olarak verilenin çerçevesi içine, o bireyin maruz kaldığı, hiç bir zaman başka bir bireyle tam anlamıyla örtüşmeyecek olan, emsalsiz yaşantı parçalarının temsili, yukarda anılan mekanizmalarla, kişiliği de oluşturmak üzere yerleşir. Erişkin MSSnin plastik dinamizmi gelişimsel aşamadaki düzeyini yitirir. Gelişimsel dönemde her kritik yeni yaşantılama kişiliği oluşturacak yeni bir yapıtaşı olarak MSSye kaydedilirken, erişkin dönemde artık kritik yaşam deneyimleri bu denli büyük değişikliklere yol açmaz. Gelişimsel dönemde bir hemisferektomiyi tolere edebilecek durumda olan MSS, erişkinliğe ulaştıktan sonra bir hemisferin çok daha sınırlı bir alanındaki hasar sonucu ağır düzeyde sakatlanabilir. Yine de, nöroplastisite erişkin dönemle birlikte tümden durmaz. Yeni öğrenme, aşınma ve hasar onarımı amaçlı olarak MSSnin belli bölgelerinde daha belirgin olmak üzere devam eder. Bunlar aksonal tomurcuklanma, dendritik dallanma, yeni sinaps oluşumu (sinaptogenez) ve varolan sinapsın yeniden şekillenmesi (sinaptik remodeling) ve LTP olarak sıralanabilir. Bu mekanizmalar yeni yaşantıların temsili ihtiyacına karşı yaşantılama bağımlı plastisite (modülasyonel nöroplastisite) ile aşınma, yıpranma ve hasara cevap olan reaktif veya kompansatuar plastisitenin (onarımsal nöroplastisite) temel mekanizmalarıdır.
Mesulam varsayımını bilinen AH ile ilintili tüm risk faktörleri ve patolojik ürünlerin nöroplastisiteye müdahale ettiğine ilişkin delillerle desteklemektedir. Nöroplastisite potansiyeli, AHde NFY oluşumunun yayılımı ile örtüşür biçimde en yüksek limbik sistemde iken, azalan sırayla paralimbik yapılar, asosiasyon neokorteksi ve en az da primer sensoryel-motor korteksler şeklinde kendini gösterir. MAP-τ üretimi ve fosforilizasyonunda artış plastik değişiklikler sürecinin temel işlemlerindendir. Özellikle plastisite yükünün yüksek olduğu bölgelerde kinaz-fosfataz döngüsünün dengesinin bozulması plastik talep karşısında fosforillenmiş taunun görevi bittiğinde defosforilizasyonunun sağlanamayarak yukarda söz edildiği gibi patolojik katlanmasına ve birikim eğilimi gösteren oligomerlere dönüşmesine neden olmaktadır. APP, daha önce de söz edildiği gibi, erişkin beyninde başlıca sinaptik bütünlüğün korunması olmak üzere, nöroplastisitedeki rolü deneysel olarak gösterilmiş bir membran proteinidir. APP proteolizi sonucunda α-sekretaz ile kesilen ürün olan sAPPnin de nörit büyümesi ve LTPdeki rolü bilinmektedir. Buna karşılık, β sekretazla alternatif kesim sonucu oluşan Aβ fragmanı nörotoksiktir, aksonal tomurcuklanma ve LTPyi inhibe eder. β-sekretazın distal amino terminal ürünü olan sAPPβnın da akson budanması tarzı anti-plastisite etkisinden yukarda söz edilmişti. PS1in, nörogenezde çok önemli işlevi olan NOTCH proteini ile etkileşerek işlev gördüğüne de değinilmişti. Bu etkileşimin erişkin beyninde plastisite yükseltici etkileri gösterilmiştir. PS1 ve PS2 mutasyonları APP proteolizini Aβ42 yoluna kaydırmak yanısıra, NOTCH ile anılan etkileşimi gösteremeyen bozuk ürünlere yol açarak da plastisite potansiyelini baskılıyor olabilir. Kolesterol ve fosfolipidlerin transselüler naklinde rol oynayan ve dolayısıyla aksonal büyüme ve sinaptogeneze katkıda bulunduğu düşünülebilecek ApoEnin plastisite ile ilişkisine daha önce değinilmişti. Buna göre ApoE-ε4 plastisiteyi baskılarken, ApoE-ε3 ve ε2 yükseltici etki göstermektedir. Yine östrojenin nörotrofik etkilerine değinilmişti. Yaş AH için temel risk faktörüdür. Uzun ömür doğal olarak hem yaşantılama bağımlı plastisite, hem de aşınma, yıpranma ve hasarlanmanın artmasıyla kompansatuar plastisite ihtiyacını arttırmaktadır.
Dolayısıyla da yaşla birlikte artan bu ihtiyacı karşılamak için gerek τ fosforilasyonunda ve gerekse de APP ekspresyonundaki adaptif artışla birlikte denge ne kadar plastisite yükseltici faktörler lehine ise o kadar AH patolojisinden korunulabilmekte, tersine durumda ise bir yandan serbest τ polimerlerinden NFY oluşumu, diğer yandan da Aβnın önce gevşek plaklarda birikmesi, sonrasında da bunların katı plaklara dönüşmesi artmaktadır.
Çağdaş uygarlık tek bir bireyin optimal adaptasyonu için yüksek bir kognitif kapasite, özellikle de bellek kapasitesi talep etmektedir. Çağdaş insan genetik yapısını, o dönemin doğal çevresine adaptasyon için seleksiyona uğramış 30.000 yıl önceki avcı-toplayıcı uygarlığının Homo sapiensinden miras almıştır. Avcı-toplayıcı uygarlığına kıyasla gerek bireysel olarak uzayan ömür ve gerekse de sosyal olarak nicel ve nitel açılardan olağanüstü değişen koşullar nöroplastisite yükünü taşınılamaz hale getirerek AHyi modern insanlık durumunun kaçınılmaz bir eşlikçisi yapmaktadır. Bu perspektifle bakıldığında yukarda resmedilen savaş senaryosunun tarafları da pro-plastisite ve anti-plastisite güçler olmaktadır. Dolayısıyla, nöroplastisite yüküne odaklanılmayan uzun ömür veya AH kesin tedavisi düşleri de anlamsızlaşmaktadır.
TEDAVİ
Kognitif Semptomatik Tedavi
Halen tedavinin çekirdeğini kolinesteraz inhibitörleri (ChEİler) ve memantin ile kognitif semptomatik tedavi oluşturmaktadır. Onaylanan tüm tedaviler AHD içindir. Pre-demans evrelerde onaylanmış tedavi henüz yoktur.
Kolinesteraz İnhibitörleri
Takrin (Cognex®), Amerika Besin ve İlaç İdaresi (FDA) tarafından 1993 yılında Alzheimer hastalığının tedavisi için ruhsat alsa da yan etki profili açısından sorunlu olmasından dolayı günümüzde kullanılmamaktadır. Buna karşın donepezil, rivastigmin ve galantamin sınanan çok sayıda ChEİden şimdiye kadar ruhsatlananlardır. Şimdiye kadar piyasaya verilmiş olsun olmasın klinik çalışmalarda düzgün biçimde sınanan tüm ChEİler başarılı olmuştur. Bütün ChEİler için klinik çalışmalarda genel olarak söylenebilecek olan ortak etki plaseboya göre anlamlı farklılığın yanısıra, sonlanım ölçütlerinin zaman içindeki değişim eğrileri izlendiğinde 6. ayda plasebo grubu kötüleşmişken, kötüleşmeksizin hala başlangıç noktasında olma ve 1. yılda başlangıç noktasına göre kötüleşmeye karşın ChEİ öncesi dönemin uzunlamasına izlemlerdeki bozulma hızlarına referansla (tarihsel plasebo) daha iyi durumda olmaktır. Plasebo grubundayken Dolayısıyla, ChEİlerin AHDli hastaya yaklaşık 1 yıl kazandırdığı ve tanı konulduktan sonra ilaca ne kadar erken başlanırsa o kadar iyi olduğu söylenebilir.
Donepezil (FDA onayı 1996) günde tek doz (prospektüs bilgisi akşamları önerirken biz birimimizde bazen uykuyu bozması ve fazik fizyolojik kolinerjik aktiviteyle uyumu nedeniyle sabahları tercih ediyoruz), 5 ila 10 mg tabletler şeklinde kullanılan selektif bir ChEİdir. Her 2 dozu da etkin olmakla birlikte yüksek dozun etkinliği de daha yüksektir. Başta GİSe ait olanlar olmak üzere, yan etkileriyle baş edebilmek için 4 haftada titrasyonla yüksek doza çıkmak uygundur. Sonradan piyasaya verilen ağızda eriyen şekli yutma güçlüğü de olan özellikle ileri evre hastalarda yararlı olmaktadır. Rivastigmin (FDA onayı 1997) 1.5, 3, 4.5 ve 6 mglık kapsüller şeklinde piyasadadır. Bütiril kolin esteraz (BuChE) inhibisyonu etkisi de olan ve günde iki kez kullanılan rivastigminin en düşük etkili dozu 6 mg/gün olmak üzere, 4er haftalık titrasyonlarla 12 mg/güne yükseltilmesi hedeflenmektedir. Renksiz ve kokusuz sıvı şekli ilaç kullanmayı reddeden hastalarda kullanımı kolaylaştırmıştır. AChEİlerin kafa kafaya karşılaştırıldığı en kaliteli çalışma olan, büyük boyutlu ve uzun süreli EXCEED isimli çalışmada ikinci yılın sonunda rivastigmin 2 ikincil sonlanım ölçütünde (demans evrelendirmesi ve GYAlar) donepezile üstün bulunmuşsa da donepezil de ilk 4 aylık titrasyon döneminde rivastigmine kıyasla anlamlı ölçüde daha iyi tolere edilmiştir. Birincil sonlanım ölçütü (kognitif) açısından her 2 ilacı kullananların da yaklaşık %35i 2. yılın sonunda başlangıç noktalarından daha iyi durumdaydılar. Rivastigmin deriden emilen bant formunun oral formuna eşdeğer etkinliği ve plaseboya yakın tolerabilitesini gösterdiği IDEAL çalışmasıyla kayda değer bir yenilik getirmiş oldu. İlki 6mg/gün, ikincisi 12mg/gün klasik dozlarına eşit 5 ve 10 ve 15 cm 2 dozlarıyla piyasada olan bant şekli de 4 haftada titre edilmelidir. Gostrointestinal toleransı mümkün olmadığı için oral eşdeğeri olmayan 15 cm 2 ile %50 doz arttırmak mümkün olmuştur. Galantamin (FDA onayı 2001) 8, 16 ve 24 mg/gün aralığında günde iki doz şeklinde kullanılan ve pre-sinaptik allosterik nikotinik reseptör modülasyonu etkisi de olan bir ChEİdir. Önce sıvı şekli, daha sonra da yavaş emilen kapsül formu piyasaya verilmiştir. Sıvı form hala günde 2 doz şeklinde 4er haftalık titrasyonla önce etkisiz 8mg/gün ile başlanıp, 4 hafta sonra etkin olduğu ilk doz düzeyi olan 16mg/gün, son olarak da kompliyans sağlanabildiği takdirde 24mg/gün düzeyine çıkılmalıdır. Kapsül formu günde tek doz benzer titrasyon şemasıyla arttırılmalıdır. Birkaç yıldır ülkemizde piyasadan kalkmıştır. En düşük dozdan başlayıp 4 haftalık aralıklarla yükseltildiğinde üçü için de ortak problem olan bulantı-kusma ile başa çıkmak daha kolay olmaktadır. ChEİler hafif ve orta evre AHde kullanım için ruhsatlanmış olsa da ağır evrede yararlarına ilişkin gerek klinik çalışma ve gerekse de kendi deneyimizden anekdotal deliller bulunmaktadır. İlaçların etkisizlik ve kesilme kararlarına ilişkin çok aşikar göstergeler olmasa da, düzenli kullanılan ilaca karşın yıl içinde sürekli kötüleşme gözlemleri sonucunda kesme kararı verilebilir. Yine gerek bizim deneyimimiz ve gerekse birinden diğerine geçiş verileri (switch data), ilaçlardan biri kesildiğinde diğerinin kullanılmaya başlanmasının hastaların %50sinde yararlı olabildiğini göstermektedir.
ChEİlerin non-kognitif ya da davranışsal belirtiler üzerindeki olumlu etkileri de bildirilmektedir. Buna bir sonraki bölümde değinilecektir. ChEİler büyük ölçüde hafif-orta evre hastalarda çalışılmış ve bu evrelerde kullanım için endikasyon almışlardır. Bununla birlikte, orta-ağır evre çalışmaları da genellikle pozitiftir. Günümüze kadar biriken verilerin kapsamlı bir gözden geçirmesi için Cochrane veritabanına bakınız.
Memantin
ChEİlerden sonra bu kez farklı bir etki mekanizmasına sahip olan bir ajan daha onay almış, böylece kolinerjik nörotransmisyonun yanısıra glutamaterjik nörotransmisyonun da NMDA reseptör modülasyonu aracılığıyla düzenlenmesinin AHde bir tedavi stratejisi olabileceği kanıtlanmıştır. Memantin (FDA onayı 2003) düşük afiniteli bir NMDA reseptör antagonistidir. Memantinin bozuk Alzheimer sinapsında post-sinaptik NMDA reseptöründe magnezyum tıkacı görevi yaparak patolojik intraselüler kalsiyum birikimini engellediği bilinmektedir. Buna karşılık, NMDA antagonizmini geri dönüşümsüz değil fakat düşük afiniteyle yaptığından, NMDA reseptörleri aracılıklı normal glutamaterjik nörotransmisyon için gerekli olan depolarizan bir uyaranla magnezyumun yapacağı gibi reseptörü terketmekte ve böylelikle de LTP mekanizmasına engel olmamaktadır.
Memantin 10 mglık tablet şeklinde piyasaya verilmiştir ve günde 2 doz kullanılacak şekilde, haftada 5 mglık artışlarla 4. haftada 20 mg/gün dozuna ulaşılır. Sonradan bu günlük dozun gece tek doz verilmesinin de tolerabiliteyi bozmadığı, buna karşılık bir kısım hastada görülebilen gündüz sedasyonuyla başa çıkmayı kolaylaştırdığı görülmüştür. İzleyerek, memantinin de sıvı formu 10 damla = 5mg olacak şekilde geliştirilmiş ve ChEİlerde olduğu gibi yutma güçlüğü ve ilaç reddi olan hastalarda kullanım kolaylığı sağlamıştır. Yine de günlük toplam doza 40 damlayla ulaşılması bir güçlük nedeniyken bu sorun da daha sonradan piyasaya verilen pompalı sıvı formuyla aşılmış gibi görünmektedir. Bu yeni formda bir bardak su içine akacak şekilde pompa düzeneğine bir kez basış 5 mg eşdeğeri memantin sağlamaktadır.
AHde mevcut tedaviler olan ChEİler ve memantinin etkileri genel olarak mütevazi görünse de bu tedavilerin erişilebilir olmasından itibaren hasta ve yakınlarının yaşam kalitelerine katkıları olduğu kuşkusuzdur. Bu yönde özellikle de endüstri sponsorluğunda olmayan, ABDnin 2 ayrı mükemmeliyet merkezi diyebileceğimiz Alzheimer merkezinden gelen 2 bağımsız çalışmanın verileri oldukça önemlidir. Bunların ilkinde Boston, Massachusetts General Hospital Alzheimer Merkezinin 1990-2005 yılları arasındaki verileri analiz edilmiştir. Bu 15 yılın başları ilaçsız dönem, ortaları sadece ChEİlere erişilebilen dönem ve sonları ise ChEİ memantin kombinasyonunun mümkün olduğu dönemdir. Bu çalışmanın sonuçları, ortalama 30 ay izlenen 382 hastada, kognitif ve fonksiyonel sonlanım ölçütleri açısından tek başına ChEİ kullanan grubun ilaçsız gruptan daha iyi, ChEİ+memantin kombinasyon tedavisi kullanan grubun ise her ikisinden de daha iyi olduğu yönündedir. İkincisinde Pittsburgh Üniversitesi Alzheimer Merkezinin 1983-2006 arası verileri analiz edilmiştir. Bu 23 yıllık dönem de benzer şekilde ilaçsız, tek başına ChEİli ve kombinasyon tedavili dönemler olarak ayrılabiliyor. Bu kez bakımevine yatırılma bir sonlanım ölçütü olarak alınmış ve ortalama 60 ay izlenen hastalarda tek başına ChEİnin ilaçsız gruba göre bu süreyi geciktirdiği, kombinasyon tedavisinin ise yine her ikisine göre daha da geciktirdiği gösterilmiştir.
Non-Kognitif Semptomatik Tedavi
ChEİlerin özellikle halüsinasyon ve hezeyanlar şeklindeki psikotik belirtilere, ajitasyon ve apatiye iyi gelebildiği gösterilmiştir. Benzer şekilde, memantin de psikotik belirtileri ve özellikle de ajitasyonu iyileştirebilmektedir. Biriken verilerin analizi memantinin mevcut ajitasyonu kontrol altına alabildiği gibi uzunlamasına izlemde ilaç kullanan hastalarda daha az ajitasyon ortaya çıktığı gözlemlenmiştir. Dolayısıyla da, bu anılan belirtilerin şiddetleri anti-psikotiklerle derhal müdahaleyi gerektirmediği durumlarda yeni başlanılan bir ChEİnin ve/veya memantinin onların üzerine muhtemel etkisini değerlendirmekle gereksiz ilaç kullanımının da önüne geçilmiş olur.
Depresyon, mani ve anksiyete gibi duygudurum bozuklukları AHde sıktır. Depresyon tedavisinde öncelikle bu yaş grubunda sık kullanılan ve depresyonu bizzat ortaya çıkarabilecek veya şiddetlendirebilecek olan reserpin, α-metil-dopa, β-blokerler gibi anti-hipertansifler kesilerek kalsiyum kanal blokerleri veya ACE inhibitörleri gibi daha uygun ilaçlara geçilmelidir. Trisiklik anti-depresanlar anti-kolinerjik yan etkileri nedeniyle seçilmemesi gereken gruptur. SSRI grubundan ilaçlar, venlafaksin, mirtazapin, duloksetin gibi yeni kuşak hem serotonin, hem de noradrenalin gerialım blokeri olan (SNRI) anti-depresanlar güvenle kullanılabilir. Tam bir mani oldukça seyrek olsa da emosyonel labilite, iritabilite ve öfori gibi özellikleri bazen tedavi gerektirebilir. Bu durumda lityum, karbamazepin ve valproat gibi duygudurum stabilizatörleri kullanılabilir. Anksiyete tedavisinde çok gerekmedikçe kognitif depresan etkileri nedeniyle benzodiazepinlerden kaçınılmalıdır. SSRIlar ve trazodon bu amaçla öncelikle seçilebilir. Etkisiz kaldığında lorazepam (Ativan®) veya alprozalam (Xanax®) gibi kısa etkili benzodiazepinler tercih edilmelidir.
Hezeyan ve halüsinasyon gibi psikotik belirtilerin tedavisinde ekstrapiramidal ve anti-kolinerjik yan etkilerden arınmışlık başlıca tercih nedenidir. Bu nedenle atipik nöroleptikler öncelikle tercih edilenlerdir. Risperidon ve olanzapinin ekstrapiramidal yan etki potansiyelleri onları gerçek anlamda birer atipik olarak sınıflamayı engellemektedir. Risperidonun aktif metaboliti olan paliperidol kilo aldırmaması ve belirgin sedasyon yapmaması nedeniyle tercih edilebillir. Klozapin çok etkili bir atipik olsa da kemik iliği baskılama potansiyeli nedeniyle haftalık lökosit sayımlarının getirdiği güçlük kullanımını sınırlamaktadır. Atipikler arasında ketiapin diğerleri için sıralanan kısıtlamalardan arınmış ve geniş bir güvenlik aralığında rahatlıkla kullanılabilmektedir. Diğerleriyle kıyaslanamayacak kadar ucuz olması düşük dozlarda haloperidolün tipik bir nöroleptik olsa da hala bir seçenek olarak korunmasına neden olmaktadır. Demansta psikoz tedavisinde çok düşük dozlarda başlayıp optimal dozu olguya göre uyarlamak esastır. Dozun tümünü ya da büyük bölümünü gündüz sedasyonundan kaçınmak amacıyla geceleri vermek uygun olur. Ketiapin 50 ila 100 mglık dozlarda genellikle etkin olurken, 400 mg/gün düzeylerine çıkarmak da gerekebilir. Risperidon 0,5 ila 1 mg, seyrek olarak da 2 mg/gün dozlarında kulanılır. Olanzapin dozu 2,5-5 mg, bazen 10 mg/gündür; bir klinik çalışmada 15 mg/günden itibaren etkinliğinin paradoksal olarak düştüğü gösterilmiştir. Klozapin 6.25 mg ila 50 mg/gün dozlarında yeterli etkinlik gösterse de bazen 200 mg/gün dozlarına kadar çıkmak gerekebilmektedir. Haloperidol dozu 1 ila 3 mg/gün arasında değişebilir ve damla şeklinde kullanımı bir avantaj olarak düşünülebilir.
Ajitasyon ve saldırganlığın tedavisinde yine atipik nöroleptikler ilk seçimlerdir. Ajitasyon için bazen tek başına trazodonla başlayıp cevap alınmazsa nöroleptikleri tercih etmek bir seçenek olabilir. Karbamazepin, valproat ve lityum da tek başına ya da ilave tedavi olarak denenebilir.
İmpulsivite ve dürtü kontrol kusurlarının tedavisinde öncelikle SSRIlar denenir. Hiperseksüalite için ayrıca anti-androjen ajanlar kullanılabilir.
Uykusuzluk tedavisinde ilaçtan önce güneş batımı sonrası kahve ve çaydan kaçınmak ve yatmadan bir süre önce içilecek ılık süt önerilmelidir. Gerçekte bir anti-depresan olan trazodon 50-200 mg dozları arasında yatmadan 1 saat önce verildiğinde oldukça etkin bir sedatif etki gösterir. Mirtazapin yatmadan önce ½ tablet (15mg) dozunda benzer etkiye sahiptir. Sirkadiyen ritmin düzenlenmesi amacıyla Melatonin 3 mg dozunda başlanıp 12 mga kadar yükseltilebilir. Ayrıca bir melatonin reseptör agonisti Ramelteon 8 mg melatoninle benzer etkiye sahiptir.
Non-Farmakolojik Tedavi
Tedaviye non-farmakolojik yaklaşım hasta ve hasta yakını ile kurulan ve hastalıkla başa çıkmaya yönelik ilaç dışı etkileşimin bütününü içermektedir.
Bunlar farklı başlıklarda sıralanabileceği gibi hastalık evrelerine göre de farklılık gösterir. Evresel perspektif şöyle özetlenebilir:
Erken evrede hastalık hasta ve hasta yakınına kültüre uyumlu bir şekilde anlaşılabilir bir şekilde aktarılır ve hastalığın mümkün olduğunca ayrıntılı bir şekilde kavranacağı internet, Alzheimer dernek ve vakıflarının ve benzeri kaynakların dergi, broşür, kitap gibi bilgilendirici yayınlarının okunması teşvik edilir. Hastayla vesayet meselelerini de içerecek şekilde, geleceğin gerçekçi bir biçimde tasarlanmasına yönelik tartışılmaya gayret edilir. Hobiler ve sosyal ilişkileri sürdürmenin önemi aktarılır. Araba kullanmayı sürdürmenin sakıncalarından sözedilir. Hasta yakınına destek grupları hakkında bilgi verilir ve dernek aktivitelerinde yer alması doğrultusunda cesaretlendirilir.
Orta evrede hasta ve hasta yakınına yalnız sokağa çıkmanın sakıncaları anlatılır. Mali ve bunun gibi hukuksal işlerde artık vesayetin zorunluluğu aktarılır. Ev aygıtlarını kullanmadaki güçlükler ve kaza ihtimalleri gözden geçirilir. Giyinmek, yıkanmak ve sofra davranışı gibi güçlükler ele alınır. Artık yalnız yaşamaması yönünde teşvik edilir ve alternatifler ele alınır. Psikotik belirtiler mevcutsa çevresel müdahalelerle başa çıkılmasına gayret edilir. Sfinkter kontrolünü arttırıcı yöntemler üzerinde durulur. Bu tür kuruluşlar o çevrede mevcut olduğunda gündüz bakım evlerinin değerlendirilmesi teşvik edilir. Hasta yakını yükü gözden geçirilir ve muhtemel bir depresyona karşı önlem alınır.
İleri evrede hasta yakınıyla suçluluk duyguları, hastalık yükü ve kayıp üzerine tartışılır. Evde profesyonel yardım ve bir ötesi olarak kalıcı bir bakımevine nakil üzerine tartışılır ve teşvik edilir. Yatak yaraları, kontraktürler, üriner ve solunum sistemi enfeksiyonları riskleri konusunda uyarılır. Sonda ile beslenme gerekliliği ele alınır. Nihayet terminal bakım ve ölüm meseleleri üzerinde durulur.
Spesifik müdahale alanları ise aşağıdaki şekilde sıralanabilir:
İşlevsel performans açısından sözel ipuçlarından fiziksel olarak göstermeye kadar değişen kademeli yardımın demanslı hastanın günlük performansını arttırdığı gösterilmiştir. Davranış modifikasyonu ile tuvaletin uyarılması veya saatlerinin önceden belirlenmesi kuru kalmayı teşvik eder. Uğraşı rehabilitasyonu kognitif performans, psikososyal işlevsellik ve emosyonel dengeyi düzeltir. Işığın azaltılması ve seslerin sükünet verici bir duruma getirilmesi gibi çevresel manipülasyonların yeme davranışını arttırdığı gösterilmiştir.
Davranışsal problemler açısından banyo ve sofra sırasında müziğin ajitasyon ve saldırganlığı azalttığı gösterilmiştir. Mevcudiyetin simülasyonu tedavisi adı verilen aile üyelerinin ses ve görüntü kayıtlarının dinletilmesi veya izletilmesinin de benzer etkisi olduğuna ilişkin bildirimler vardır. Yürüyüş ve benzeri hafif egzersizler gezinme-adımlama davranışının önüne geçebilir. Psikotik belirtiler saldırganlık, kaçma veya yemeyi reddetme gibi tehlikeli veya aşırı sıkıntı verici şiddette değilse yeniden yönlendirme (konuyu değiştirme) en iyi başa çıkma yoludur. Ajitasyon ve saldırganlık için de yeniden yönlendirme, dikkatini çelme ve aktivite tedavisi etkili olabilir. Öncelikle eğer ayırt edilebiliyorsa ajitasyonu tetikleyen olayın önüne geçilmeye çalışılmalıdır (örneğin, aynadaki yabancı görüntüden ürküp kavga eden hasta için aynaların kaldırılması).
Hasta yakınları için hastalık hakkında kısa ve uzun süreli eğitim programlarının sıkıntıyı azaltan ve nihai evreyi geciktiren etkileri kesin bir biçimde gösterilmiştir. Hasta yakını destek gruplarının emosyonel denge açısından büyük önemi vardır. Bilgisayar ağları, telefon desteği eğitim için kullanılacak seçeneklerdir. Gündüz bakım evlerinin hasta yakını yükü açısından olumlu etkisi kuşkusuzdur.
Kaynaklar
1. Albert, M. ve ark. The diagnosis of mild cognitive impairment due to Alzheimer's disease: recommendations from the National Institute on Aging-Alzheimer's Association workgroups on diagnostic guidelines for Alzheimer's disease. Alzheimers Dement. 2011; 7: 270-279.
2. Blennow, K.; Hampel, H. CSF markers for incipient Alzheimers disease. Lancet Neurol, 2003; 2: 605613.
3. Crous-Bou, ve ark. Alzheimers disease prevention: from risk factors to early intervention. Alzheimer's Research & Therapy. 2017; 9: 71.
4. Dubois, B., ve ark. Research criteria for the diagnosis of Alzheimer's disease: revising the NINCDS-ADRDA criteria. Lancet Neurol. 2007; 6, 734-746.
5. Dubois, ve ark. Advancing research diagnostic criteria for Alzheimer's disease: the IWG-2 criteria. Lancet Neurol. 2014; 13, 614-629.
6. Fann, J. R., ve ark. Modifiable risk Factors for Alzheimers Disease. Front. Aging Neurosci. 2019; 11:146.
7. Gurvit H, ve ark. The prevalence of dementia in an urban Turkish population. Am J Alzheimers Dis Other Demen. 2008; 23: 67-76.
8. Jack, C. R. ve ark. NIA-AA Research Framework: Toward a biological definition of Alzheimer's disease. Alzheimers Dement. 2018; 14, 535-562.
9. Jorm, A.F., Jolley, D. The incidence of dementia: a meta-analysis. Neurology. 1998 ;51: 728-33.
10. McKhann, ve ark. The diagnosis of dementia due to Alzheimer's disease: recommendations from the National Institute on Aging-Alzheimer's Association workgroups on diagnostic guidelines for Alzheimer's disease. Alzheimers Dement. 2011; 7: 263-269.
11. Smailagic N, ve ark. 18F-FDG PET for the early diagnosis of Alzheimers disease dementia and other dementias in people with mild cognitive impairment (MCI). Vol. 2017, Cochrane Database of Systematic Reviews. Wiley; 2015.
12. Sperling, R. A., ve ark. Toward defining the preclinical stages of Alzheimer's disease: recommendations from the National Institute on Aging-Alzheimer's Association workgroups on diagnostic guidelines for Alzheimer's disease. Alzheimers Dement. 2011; 7: 280-292.
13. Tijms, B. M., ve ark. Pre-amyloid stage of Alzheimer's disease in cognitively normal individuals. Ann Clin Transl Neurol. 2018; 5:1037-1047.
14. Vos SJB, et al. Modifiable risk factors for prevention of dementia in midlife, late life and the oldest-old: validation of the LIBRA Index. J Alzheimers Dis. 2017;58:53747.
15. Young, P. N. E., ve ark. Imaging biomarkers in neurodegeneration: current and future practices. Alzheimer's Research & Therapy. 2020; 12: 49.
16. Braak, H., & Braak, E. Neuropathological stageing of Alzheimer-related changes. Acta Neuropathol. 1991; 82, 239-259.